
【题目】二甲醚和乙醇是两种常见的有机溶剂,也可作为新能源。
(1)通过以下反应可获得二甲醚(CH3OCH3):
①CO(g)+H2O(g)=CO2(g)+H2(g) ΔH 1=a kJ·molˉ1
②CO2(g)+3H2(g)=CH3OH(g)+H2O(g) ΔH 2=b kJ·molˉ1
③2CH3OH(g)=CH3OCH3(g)+H2O(g) ΔH 3=c kJ·molˉ1
则反应 2CO(g)+4H2(g)=CH3OCH3(g)+H2O(g)的 ΔH=_________kJ·molˉ1。
(2)已知气相直接水合法可以制取乙醇:H2O(g)+C2H4(g) ![]() CH3CH2OH(g)。
CH3CH2OH(g)。
在 n(H2O)∶n(C2H4)=1∶1 的条件下投料,乙烯的平衡转化率与温度(T)及压强(p) 的关系如图1所示。
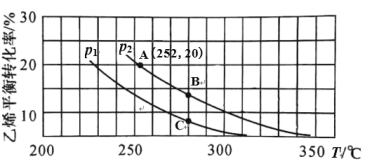 图1
图1
①下列有关说法中正确的是_________。
A.p1>p2 B.280℃时,vB>vC
C.A、B、C 三点的平衡常数 KA>KB>KC D.低温有利于该反应自发进行
②在 p2,280℃条件下,C 点的 v 正 ____v 逆 (填“>”、“<”或“=”),理由是________。
③计算图 1 中 A 点的平衡常数 Kp=_________。(结果用 p2 的代数式表示,平衡分压代替平衡浓度计算,分压=总压×物质的量分数)
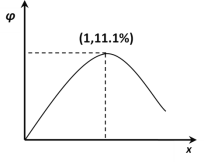
(3)在 n(H2O)∶n(C2H4)=1∶x 的条件下投料,某研究小组在压强为 p2,温度为 252℃ 时,进行平衡体系中乙醇的体积分数随投料比变化的测定实验。在图 2 中画出平衡体系中乙醇的体积分数 φ 随 x 变化的示意图____。
【答案】2a+2b+c BD > 在p2,280℃条件下,平衡转化率在B点位置,说明C点未达平衡状态,反应正向进行 ![]()
【解析】
(1)通过以下反应可获得二甲醚(CH3OCH3):
①CO(g)+H2O(g)=CO2(g)+H2(g) ΔH 1=a kJ·molˉ1
②CO2(g)+3H2(g)=CH3OH(g)+H2O(g) ΔH 2=b kJ·molˉ1
③2CH3OH(g)=CH3OCH3(g)+H2O(g) ΔH 3=c kJ·molˉ1
由盖斯定律,2×①+2×②+③得:反应 2CO(g)+4H2(g)=CH3OCH3(g)+H2O(g)的 ΔH=(2a+2b+c)kJ·molˉ1。
故答案为:2a+2b+c;
(2)①A.当温度相同时,从p1到p2乙烯转化率增大,平衡正向移动,p1<p2 ,故A错误;
B.280℃时,B点压强大,vB>vC,故B正确;
C.压强为P2时升高温度,乙烯转化率减小,平衡常数减小,但BC温度相同,平衡常数相同,A、B、C 三点的平衡常数 KA>KB=KC ,故C错误;
D.升高温度,乙烯转化率减小,△H<0,△S<0,低温有利于该反应自发进行,故D正确;
故答案为:BD;
②在 p2,280℃条件下,C 点的 v 正>v 逆;理由是:在p2,280℃条件下,平衡转化率在B点位置,说明C点未达平衡状态,反应正向进行;
故答案为:>;在p2,280℃条件下,平衡转化率在B点位置,说明C点未达平衡状态,反应正向进行;
③计算图 1 中 A 点的平衡常数:
乙醇占![]() =
=![]() ,乙烯和水各占
,乙烯和水各占![]() =
=![]() ,Kp=
,Kp=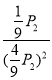
![]() 。故答案为:
。故答案为:![]() ;
;
(3)在 n(H2O)∶n(C2H4)=1∶x 的条件下投料,某研究小组在压强为 p2,温度为 252℃ 时,进行平衡体系中乙醇的体积分数随投料比变化的测定实验。n(H2O)∶n(C2H4)=1∶1时,乙烯的转化率最大,![]() ,或11.1%,画出平衡体系中乙醇的体积分数 φ 随 x 变化的示意图
,或11.1%,画出平衡体系中乙醇的体积分数 φ 随 x 变化的示意图![]() 。
。
故答案为: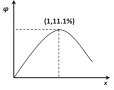 ;
;


 智趣暑假温故知新系列答案
智趣暑假温故知新系列答案 英语小英雄天天默写系列答案
英语小英雄天天默写系列答案 暑假作业安徽少年儿童出版社系列答案
暑假作业安徽少年儿童出版社系列答案科目:高中化学 来源: 题型:
【题目】用CO2和H2合成甲醇的化学方程式为CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) H,按相同的物质的量投料,测得CO2在不同温度下(T1< T2)的平衡转化率与压强的关系如下图所示。下列说法正确的是
CH3OH(g)+H2O(g) H,按相同的物质的量投料,测得CO2在不同温度下(T1< T2)的平衡转化率与压强的关系如下图所示。下列说法正确的是
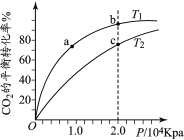
A.该反应的ΔH>0B.正反应速率:υ(a)>υ(c)
C.CH3OH的体积分数:φ(b)<φ(a)D.平衡常数:K(b)>K(c)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】孟鲁司特钠可用于抗新型冠状病毒肺炎,其制备中间体G 的一种合成路线如下:
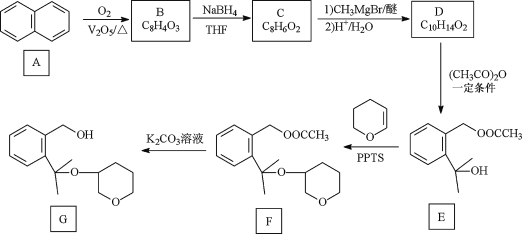
已知:① B、C除苯环外还含有一个五元环,D的苯环上只有两个取代基;
②RX![]() RMgX
RMgX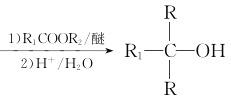
回答下列问题:
(1)A 的化学名称是____________________。
(2)F中含氧官能团名称是____________________________。
(3)B的结构简式为 ______________________________________。
(4)D生成E同时生成乙酸的化学方程式为___________________________________。
(5)E生成F的反应类型是________________。
(6)化合物 W 与G 互为同分异构体,能发生水解反应,其核磁共振氢谱有四组峰且峰面积之比为9:9:2:2,则 W 的结构简式为_____________________(写一种) 。
(7)设计以苯甲酸和乙醇为起始原料制备3-苯基-3-戊醇(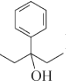 )的合成路线: _____________________________________________(无机试剂及有机溶剂任用) 。
)的合成路线: _____________________________________________(无机试剂及有机溶剂任用) 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将5g某金属加入到100mL 2mol L-1的硫酸溶液中,当硫酸浓度降低到原浓度的一半时(设溶液体积不变),金属还没有全部溶解。该金属可能是
A.AlB.ZnC.FeD.Na
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某固体样品可能含有Cu、SiO2、Fe2O3、Na2CO3、KAl(SO4)2、KNO3 中的若干种。为确定其组成,实验过程及产物如下:
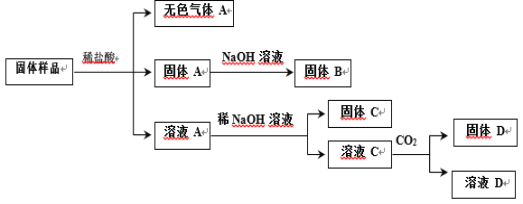
已知:①所用试剂均过量;②固体 B 的质量小于固体 A。下列说法正确的是
A.无色气体一定是纯净物
B.固体样品中一定有 Cu、Fe2O3、SiO2、Na2CO3
C.向溶液 A 加入足量浓氨水所得固体质量可能与固体 C 质量相等
D.向溶液 C 中通入 CO2 可改为进行焰色反应(透过蓝色钴玻璃片),不影响实验结论
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知X为FeO与CuO的混合物,取两份等质量的X样品进行下列实验:
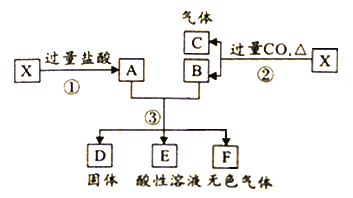
(1)写出步骤③中所有氧化还原反应的化学方程式______________。
(2)设步骤③中所得固体D的质量为32g,溶液E中只含有一种金属离子,气体F在标准状况下体积为5.6L,试计算取用的每份X的质量为______________,X中FeO与CuO的质量之比为_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式书写正确的是( )
A.向溴水中通入SO2:SO2+2H2O+Br2=2H++SO42-+2HBr
B.碳酸氢钠溶液与足量的氢氧化钡溶液混合:HCO3-+Ba2++OH-=BaCO3↓+H2O
C.漂白粉溶液在空气中失效:2ClO-+CO2+H2O=2HClO+CO32-
D.实验室制氢氧化铁胶体:Fe3++3H2O![]() Fe(OH)3↓+3H+
Fe(OH)3↓+3H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.(1) SiH4是一种无色气体,遇到空气能发生爆炸性自燃,生成SiO2(s)和H2O(l)。已知室温下2 g SiH4自燃放出的热量为89.2 kJ,则其热化学方程式为: _____________________。
(2)沼气是一种能源,它的主要成分是CH4,其燃烧的热化学方程式为:CH4(g)+2O2(g) = CO2(g)+2H2O(l ) ΔH=-890 kJ/mol,又已知H2O(l)=H2O(g) ΔH=+44 kJ/mol,则11.2 L(标准状况)CH4完全燃烧生成气态水时放出的热量为_______________。
Ⅱ.已知下列几种烷烃的燃烧热如下:
烷烃 | 甲烷 | 乙烷 | 丙烷 | 丁烷 | 戊烷 | 己烷 |
燃烧热/ (kJ·mol-1) | 890.3 | 1559.8 | 2219.9 | 2877.0 | 3536.2 | 4163.1 |
今有10 L(标准状况下)某种天然气,假设仅含甲烷和乙烷两种气体,燃烧时共放出热量480 kJ。
(1)试写出乙烷气体燃烧的热化学方程式___________________________________。
(2)计算该天然气中甲烷的体积分数____________(保留小数点后两位)。
(3)由上表可总结出的近似规律是______________________________________________。
(4)根据(3)的近似规律可预测癸烷的燃烧热约为______kJ·mol-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将4mol/L的Na2CO3溶液250mL稀释到1000mL,
(1)求稀释后溶液中溶质Na2CO3的质量。___
(2)求稀释后溶液中Na2CO3的物质的量浓度。___
(3)将稀释后的1000mL溶液取出400mL,求余下溶液中Na+的物质的量浓度。___
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com