
【题目】已知X为FeO与CuO的混合物,取两份等质量的X样品进行下列实验:
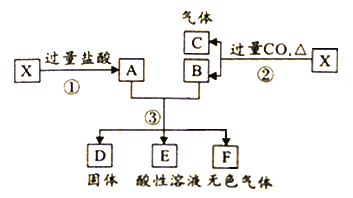
(1)写出步骤③中所有氧化还原反应的化学方程式______________。
(2)设步骤③中所得固体D的质量为32g,溶液E中只含有一种金属离子,气体F在标准状况下体积为5.6L,试计算取用的每份X的质量为______________,X中FeO与CuO的质量之比为_____________。
【答案】Fe+2HCl=FeCl2+H2 ,CuCl2+ Fe= FeCl2+ Cu 56g 9:5
【解析】
(1)步骤③中,共发生两个氧化还原反应,一个是Fe与Cu2+反应,另一个是Fe与H+反应。
(2)步骤③中所得固体D为Cu,来自两份混合物的转化,质量共为32g,则每份混合物中所含Cu元素的质量为16g,CuO的物质的量![]() 。溶液E中只含有一种金属离子(Fe2+),气体F由过量的Fe与盐酸反应产生,在标准状况下体积为5.6L,物质的量为
。溶液E中只含有一种金属离子(Fe2+),气体F由过量的Fe与盐酸反应产生,在标准状况下体积为5.6L,物质的量为![]() 。先求出每份中所含Fe、Cu原子的物质的量,再求出FeO、CuO的质量。
。先求出每份中所含Fe、Cu原子的物质的量,再求出FeO、CuO的质量。
(1)步骤③中,共发生两个氧化还原反应,化学方程式为:Fe+2HCl=FeCl2+H2↑,CuCl2+ Fe= FeCl2+ Cu。答案为:Fe+2HCl=FeCl2+H2↑,CuCl2+ Fe= FeCl2+ Cu;
(2)步骤③中所得固体D为Cu,来自两份混合物的转化,质量共为32g,则每份混合物中所含Cu元素的质量为16g,CuO的物质的量![]() 。溶液E中只含有一种金属离子(Fe2+),气体F由过量的Fe与盐酸反应产生,在标准状况下体积为5.6L,物质的量为
。溶液E中只含有一种金属离子(Fe2+),气体F由过量的Fe与盐酸反应产生,在标准状况下体积为5.6L,物质的量为![]() 。由CuCl2+ Fe= FeCl2+ Cu,n(Cu)=0.25mol,则参加反应的Fe为0.25mol;由Fe+2HCl=FeCl2+H2↑,n(H2)=0.25mol,可求出Fe为0.25mol。由此可得出CuO为0.25mol,质量为0.25mol×80g/mol=20g;FeO为0.25mol+0.25mol=0.5mol,质量为0.5mol×72g/mol=36g。取用的每份X的质量为36g+20g=56g,X中FeO与CuO的质量之比为36g:20g=9:5。答案为:56g;9:5。
。由CuCl2+ Fe= FeCl2+ Cu,n(Cu)=0.25mol,则参加反应的Fe为0.25mol;由Fe+2HCl=FeCl2+H2↑,n(H2)=0.25mol,可求出Fe为0.25mol。由此可得出CuO为0.25mol,质量为0.25mol×80g/mol=20g;FeO为0.25mol+0.25mol=0.5mol,质量为0.5mol×72g/mol=36g。取用的每份X的质量为36g+20g=56g,X中FeO与CuO的质量之比为36g:20g=9:5。答案为:56g;9:5。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】某同学设计下图装置进行电解饱和食盐水自制“84”消毒液。回答下列问题

(1)电解饱和食盐水时,a连接电源的_________极(填“正”或“负”)。
(2)利用该装置自制消毒液的化学反应方程式是_________。
(3)①“84”消毒液不用时需要密封保存,否则会与空气中_________发生反应,生成不稳定的物质。
②该同学利用传感技术进行某溶液中次氯酸的稳定性实验。用强光照射盛有该溶液的广口瓶,过程中溶液的pH、Cl-的浓度、瓶中氧气的体积分数变化如下图:
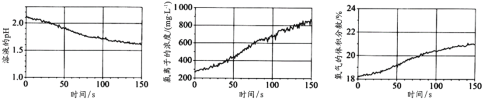
该同学分析数据得出的结论是_________(用化学方程式表示)。
(4)“84”消毒液不能与洁厕灵混用,也不能与消毒酒精混用,请从物质性质的角度解释“84”消毒液不能与消毒酒精混用的原因________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是由常见元素组成的一些单质及其化合物之间的转化关系图。各方框表示有关的一种反应物或生成物(部分物质已经略去)。其中A、B、D在常温下均为无色无味的气体,C是能使湿润的红色石蕊试纸变蓝的气体,M是最常见的无色液体。

(1)写出C→E的化学方程式: 。
(2)实验室常用加热两种固体混合物的方法制备物质C,其化学方程式为: ,干燥C常用 (填写试剂名称)。
(3)E物质遇到D物质时,会观察到 现象,若用排水法收集F,则最终集气瓶中收集到的气体为 (填写物质的化学式)。
(4)写出A→D的化学方程式: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家制造出一种使用固态电解质的燃料电池,其效率更高,可用于航天航空。如图1所示装置中,以稀土金属材料作为惰性电极,在电极上分别通入CH4和空气,其中固态电解质是掺杂了Y2O3的ZrO2固体,它在高温下能传导O2-(O2+4e-=2O2-)。
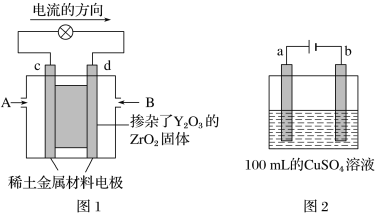
(1)c电极的名称为________(填“正极”或“负极”),d电极上的电极反应式为: ____。
(2)如图2所示用惰性电极电解100 mL 0.5 mol·L-1CuSO4溶液,a电极上的电极反应式为: __________,若a电极产生56 mL(标准状况)气体,则所得溶液的c(H+)=________(不考虑溶液体积变化),若要使电解质溶液恢复到电解前的状态,可加入________(填字母)。
a.CuO b.Cu(OH)2 c.CuCO3 d.Cu2(OH)2CO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二甲醚和乙醇是两种常见的有机溶剂,也可作为新能源。
(1)通过以下反应可获得二甲醚(CH3OCH3):
①CO(g)+H2O(g)=CO2(g)+H2(g) ΔH 1=a kJ·molˉ1
②CO2(g)+3H2(g)=CH3OH(g)+H2O(g) ΔH 2=b kJ·molˉ1
③2CH3OH(g)=CH3OCH3(g)+H2O(g) ΔH 3=c kJ·molˉ1
则反应 2CO(g)+4H2(g)=CH3OCH3(g)+H2O(g)的 ΔH=_________kJ·molˉ1。
(2)已知气相直接水合法可以制取乙醇:H2O(g)+C2H4(g) ![]() CH3CH2OH(g)。
CH3CH2OH(g)。
在 n(H2O)∶n(C2H4)=1∶1 的条件下投料,乙烯的平衡转化率与温度(T)及压强(p) 的关系如图1所示。
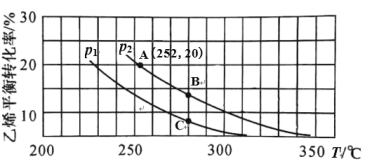 图1
图1
①下列有关说法中正确的是_________。
A.p1>p2 B.280℃时,vB>vC
C.A、B、C 三点的平衡常数 KA>KB>KC D.低温有利于该反应自发进行
②在 p2,280℃条件下,C 点的 v 正 ____v 逆 (填“>”、“<”或“=”),理由是________。
③计算图 1 中 A 点的平衡常数 Kp=_________。(结果用 p2 的代数式表示,平衡分压代替平衡浓度计算,分压=总压×物质的量分数)
(3)在 n(H2O)∶n(C2H4)=1∶x 的条件下投料,某研究小组在压强为 p2,温度为 252℃ 时,进行平衡体系中乙醇的体积分数随投料比变化的测定实验。在图 2 中画出平衡体系中乙醇的体积分数 φ 随 x 变化的示意图____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.白色无机盐 X(含三种元素,相对分子质量小于 400)能与水发生反应。为了探究 X 的组成,设计并完成了以下实验:
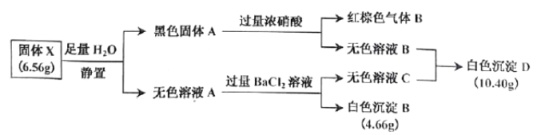
已知:白色沉淀 D 中的一种成分及质量与沉淀 B 相同。
(1)白色沉淀 D 的成分为_________(填写化学式)。
(2)黑色固体 A 与浓硝酸反应的离子方程式是_________。
(3)X 与 H2O 反应的化学方程式是_________。
Ⅱ.已知:①将 0.1 mol·Lˉ1KI 溶液加入到 0.1 mol·Lˉ1 FeCl3 溶液中时,可以看到溶液颜色加深,滴加淀粉后溶液变为蓝色;②当离子浓度相同时,氧化性:Ag+>Fe3+;③ 若浓度减小时,离子的氧化性也会随之减弱。
(1)甲同学猜测,0.1 mol·Lˉ1 KI 溶液(事先加入几滴淀粉溶液)加入到 0.1 mol·Lˉ1AgNO3 溶液中时,溶液应变蓝色。请写出该猜测对应的离子方程式_________。实 验结果未见到蓝色。
(2)乙同学认为甲同学的实验方案有问题,理由是_________。请你用原电池的方法证明Ag+也能氧化 Iˉ,要求画出实验装置图,并标明电极材料及电解质溶液 ________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列热化学方程式或离子方程式中,正确的是
A. 0.01mol·L﹣1NH4Al(SO4)2溶液与0.02mol·L﹣1Ba(OH)2溶液等体积混合:NH4++Al3++2SO42﹣+2Ba2++4OH﹣═2BaSO4↓+Al(OH)3↓+NH3·H2O
B. 一定条件下,将0.5mol N2(g)和1.5molH2(g)置于密闭的容器中充分反应生成NH3(g),放热19.3kJ,其热化学方程式为:N2(g)+3H2(g)![]() 2NH3(g)△H=﹣38.6kJ·mol﹣1
2NH3(g)△H=﹣38.6kJ·mol﹣1
C. H2(g)+![]() O2(g)═H2O(g)△H=﹣285.8kJ·mol﹣1,则H2的燃烧热为285.8 kJ·mol﹣1
O2(g)═H2O(g)△H=﹣285.8kJ·mol﹣1,则H2的燃烧热为285.8 kJ·mol﹣1
D. CO(g)的燃烧热是283.0 kJ·mol﹣1,则CO2分解的热化学方程式为:2CO2(g)═2CO(g)+O2(g)△H=+283.0 kJ·mol﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知甲、乙、丙、X是4种中学化学中常见的物质,其转化关系符合下图。则甲和X(要求甲和X能互换)不可能是
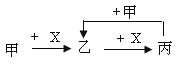
A.C和O2B.SO2 和NaOH溶液
C.Cl2和FeD.AlCl3溶液和NaOH溶液
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com