
【题目】已知甲、乙、丙、X是4种中学化学中常见的物质,其转化关系符合下图。则甲和X(要求甲和X能互换)不可能是
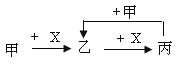
A.C和O2B.SO2 和NaOH溶液
C.Cl2和FeD.AlCl3溶液和NaOH溶液
【答案】C
【解析】
A.若甲为C,X为O2,C在O2中不完全燃烧生成的乙为CO,CO在O2中燃烧生成的丙为CO2,CO2与C高温反应生成CO,若甲为O2,X为C,O2与C反应生成的乙为CO2,CO2与C高温反应生成的丙为CO,CO与O2反应生成CO2,A可能;
B.若甲为SO2,X为NaOH,SO2与NaOH反应生成的乙为NaHSO3,NaHSO3与NaOH反应生成的丙为Na2SO3,Na2SO3与SO2、H2O反应生成NaHSO3,若甲为NaOH,X为SO2,NaOH与SO2反应生成的乙为Na2SO3,Na2SO3与SO2、H2O反应生成的丙为NaHSO3,NaHSO3与NaOH反应生成Na2SO3,B可能;
C.若甲为Cl2,X为Fe,Cl2与Fe反应生成的乙为FeCl3,FeCl3与Fe反应生成的丙为FeCl2,Cl2与FeCl2反应生成FeCl3,若甲为Fe,X为Cl2,Fe与Cl2反应生成的乙为FeCl3,但FeCl3与Cl2不反应,C不可能;
D.若甲为AlCl3,X为NaOH,AlCl3与NaOH反应生成的乙为Al(OH)3,Al(OH)3与NaOH反应生成的丙为NaAlO2,NaAlO2与AlCl3溶液反应生成Al(OH)3,若甲为NaOH溶液,X为AlCl3溶液,NaOH与AlCl3反应生成的乙为NaAlO2,NaAlO2与AlCl3溶液反应生成的丙为Al(OH)3,Al(OH)3与NaOH反应生成NaAlO2,D可能;
答案选C。


科目:高中化学 来源: 题型:
【题目】为了证明在实验室制备得到的Cl2中会混有HCl,甲同学设计了如图所示的实验装置,按要求回答下列问题。
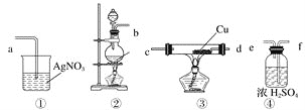
(1)请根据甲同学的示意图,所需实验装置从左至右的连接顺序:装置②→__________。
(2)装置②中主要玻璃仪器的名称__________、__________、__________。
(3)实验室制备Cl2的离子方程式为____________。
(4)装置③中Cu的作用__________(用化学方程式表示)。
(5)乙同学认为甲同学实验设计仍然存在缺陷,不能证明最终通入AgNO3溶液中的气体只有一种。为此,乙同学提出气体通入装置①之前,要加装一个检验装置⑤,以证明最终通入AgNO3溶液中的气体只有一种。你认为装置⑤应放入__________。
(6)丙同学看到甲同学设计的装置后提出无需多加装置,只需将原来烧杯中的AgNO3溶液换成紫色石蕊试液,如果观察到__________的现象,则证明制Cl2时有HCl挥发出来。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知X为FeO与CuO的混合物,取两份等质量的X样品进行下列实验:
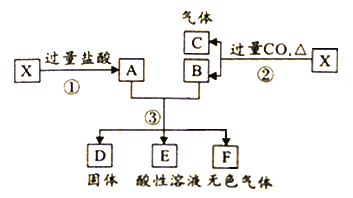
(1)写出步骤③中所有氧化还原反应的化学方程式______________。
(2)设步骤③中所得固体D的质量为32g,溶液E中只含有一种金属离子,气体F在标准状况下体积为5.6L,试计算取用的每份X的质量为______________,X中FeO与CuO的质量之比为_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定质量的铜与100 mL一定物质的量浓度的硝酸反应,铜完全溶解时产生的NO和NO2混合气体在标准状况下的体积为11.2 L。待产生的气体全部释放后,向溶液中加入100mL 6 mol·L-1的NaOH溶液,恰好使溶液中的Cu2+全部转化成沉淀,则原硝酸溶液的物质的量浓度是( )
A.6mol/LB.10mol/LC.11mol/LD.12 mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.(1) SiH4是一种无色气体,遇到空气能发生爆炸性自燃,生成SiO2(s)和H2O(l)。已知室温下2 g SiH4自燃放出的热量为89.2 kJ,则其热化学方程式为: _____________________。
(2)沼气是一种能源,它的主要成分是CH4,其燃烧的热化学方程式为:CH4(g)+2O2(g) = CO2(g)+2H2O(l ) ΔH=-890 kJ/mol,又已知H2O(l)=H2O(g) ΔH=+44 kJ/mol,则11.2 L(标准状况)CH4完全燃烧生成气态水时放出的热量为_______________。
Ⅱ.已知下列几种烷烃的燃烧热如下:
烷烃 | 甲烷 | 乙烷 | 丙烷 | 丁烷 | 戊烷 | 己烷 |
燃烧热/ (kJ·mol-1) | 890.3 | 1559.8 | 2219.9 | 2877.0 | 3536.2 | 4163.1 |
今有10 L(标准状况下)某种天然气,假设仅含甲烷和乙烷两种气体,燃烧时共放出热量480 kJ。
(1)试写出乙烷气体燃烧的热化学方程式___________________________________。
(2)计算该天然气中甲烷的体积分数____________(保留小数点后两位)。
(3)由上表可总结出的近似规律是______________________________________________。
(4)根据(3)的近似规律可预测癸烷的燃烧热约为______kJ·mol-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常用解热镇痛药对乙酰氨基苯酚(扑热息痛)为白色颗粒状晶体,易被空气氧化。实验室用对氨基苯酚乙酰化制备扑热息痛的一种方法如下:

查阅资料获得以下数据:
对氨基苯酚 | 醋酸酐 | 对乙酰氨基苯酚 | |
熔点/℃ | 189.6 ~ 190.2 | -73 | 169 ~ 171 |
密度/g·cm-3 | 1.2 | 1.1 | 1.3 |
相对分子质量 | 109 | 102 | 151 |
溶解性 | 溶于乙醇和水 | 溶于乙醇, 稍溶于水 | 易溶于乙醇和热水,溶于丙酮 |

实验过程:如图所示,在三颈烧瓶中加入对氨基苯酚10.9g,再加入30 mL水。打开仪器a下端的旋塞,缓慢滴加12 mL醋酸酐。搅拌并水浴加热,控制温度在80℃左右,充分反应后按如下流程进行操作。

回答下列问题:
(1)仪器a的名称是___________,仪器b的作用是_____________。
(2)步骤②洗涤晶体获得粗品时,选择的洗涤剂是______。(填标号)
A.乙醇 B.丙酮 C.热水 D.冷水
(3)减压过滤装置如图所示。步骤④减压过滤时,在吸滤瓶中要先加入适量NaHSO3,其作用是_________,该减压过滤需趁热进行,原因是_____________。

(4)步骤⑥中操作X为_______________。
(5)若最终得到9.8 g对乙酰氨基苯酚,则本实验的产率为______%。(保留1位小数)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应2SO2(g)+O2(g)![]() 2SO3(g) ΔH<0在一定条件下达到平衡状态,时间为t1时改变条件。化学反应速率与反应时间关系如图。下列说法中正确的是
2SO3(g) ΔH<0在一定条件下达到平衡状态,时间为t1时改变条件。化学反应速率与反应时间关系如图。下列说法中正确的是
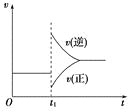
A.维持温度、反应体系体积不变,t1时充入SO3(g)
B.维持压强不变,t1时升高反应体系温度
C.维持温度不变,t1时扩大反应体系体积
D.维持温度、压强不变,t1时充入SO3(g)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设阿伏加德常数为NA,则下列说法正确的是( )
A.常温常压下,11.2LCH4中含有的氢原子数为2NA
B.标准状况下,22.4 L二氧化硫中含有氧原子数为NA
C.2.7g铝与足量的盐酸反应,失去的电子数为0.3NA
D.1L0.1mol/L MgCl2溶液中含Mg2+数为0.2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定量的Cu粉与浓H2SO4共热产生SO2气体的体积为2.24 L(标准状况下),则下列情况不可能的是( )
A.加入Cu的质量为6.4 g
B.加入的浓H2SO4中含溶质0.2 mol
C.加入Cu的质量大于6.4 g
D.加入浓H2SO4中含溶质多于0.2 mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com