
【题目】I.(1) SiH4是一种无色气体,遇到空气能发生爆炸性自燃,生成SiO2(s)和H2O(l)。已知室温下2 g SiH4自燃放出的热量为89.2 kJ,则其热化学方程式为: _____________________。
(2)沼气是一种能源,它的主要成分是CH4,其燃烧的热化学方程式为:CH4(g)+2O2(g) = CO2(g)+2H2O(l ) ΔH=-890 kJ/mol,又已知H2O(l)=H2O(g) ΔH=+44 kJ/mol,则11.2 L(标准状况)CH4完全燃烧生成气态水时放出的热量为_______________。
Ⅱ.已知下列几种烷烃的燃烧热如下:
烷烃 | 甲烷 | 乙烷 | 丙烷 | 丁烷 | 戊烷 | 己烷 |
燃烧热/ (kJ·mol-1) | 890.3 | 1559.8 | 2219.9 | 2877.0 | 3536.2 | 4163.1 |
今有10 L(标准状况下)某种天然气,假设仅含甲烷和乙烷两种气体,燃烧时共放出热量480 kJ。
(1)试写出乙烷气体燃烧的热化学方程式___________________________________。
(2)计算该天然气中甲烷的体积分数____________(保留小数点后两位)。
(3)由上表可总结出的近似规律是______________________________________________。
(4)根据(3)的近似规律可预测癸烷的燃烧热约为______kJ·mol-1。
【答案】SiH4(g)+2O2(g)=SiO2(s)+2H2O(l) △H= -1427.2kJ/mol 401kJ 2C2H6(g)+7O2(g) = 4CO2(g)+6H2O(l) △H= -3119.6 kJ/mol 72.38% 烷烃分子中每增加一个CH2原子团,燃烧热平均增加654kJ/mol左右 6779 kJ·mol-1
【解析】
I.(1) 2 g SiH4为0.0625mol,自燃放出的热量为89.2 kJ,则1 mol放出的热量为![]() =1427.2 kJ,热化学方程式为:SiH4(g)+2O2(g)=SiO2(s)+2H2O(l) △H= -1427.2kJ/mol;
=1427.2 kJ,热化学方程式为:SiH4(g)+2O2(g)=SiO2(s)+2H2O(l) △H= -1427.2kJ/mol;
答案为:SiH4(g)+2O2(g)=SiO2(s)+2H2O(l) △H= -1427.2kJ/mol;
(2)①CH4(g)+2O2(g) = CO2(g)+2H2O(l) ΔH=-890 kJ/mol,②H2O(l)==H2O(g) ΔH=+44 kJ/mol,由盖斯定律:①+②×2得:CH4(g)+2O2(g) = CO2(g)+2H2O(g) ΔH=-802 kJ/mol,1mol完全燃烧生成气态水时放出的热量802 kJ,则11.2 L(标准状况)CH4为0.5 mol完全燃烧生成气态水时放出的热量为401kJ;
答案为:401kJ;
Ⅱ(1)由表中燃烧热数值可知,1mol乙烷燃烧生成二氧化碳与液态水,放出的热量为1559.8kJ,乙烷燃烧的热化学方程式为:2C2H6(g)+7O2(g) = 4CO2(g)+6H2O(l) △H= -3119.6 kJ/mol;
故答案为:2C2H6(g)+7O2(g) = 4CO2(g)+6H2O(l) △H= -3119.6 kJ/mol
(2)10L(在标准状况下)某种天然气,假设仅含甲烷和乙烷两种气体,燃烧时共放出热量480kJ,平均燃烧热为 =1075.2kJ/mol,根据十字交叉法计算甲烷与乙烷的体积比:
=1075.2kJ/mol,根据十字交叉法计算甲烷与乙烷的体积比: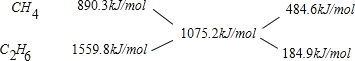
所以甲烷与乙烷的体积比为484.6:184.9,甲烷的体积分数为![]() ×100%=72.38%
×100%=72.38%
故答案为:72.38%。
(3)根据表中数据可知,碳原子数目相邻的烷烃的燃烧热之差,基本为定值,即烷烃分子中每增加一个CH2燃烧热平均增加基本为定值。
乙烷与甲烷燃烧热相差:1559.8kJ/mol-890.3kJ/mol=669.5kJ/mol,
丙烷与乙烷燃烧热相差:2219.9kJ/mol-1559.8kJ/mol=660.1kJ/mol,
丁烷与丙烷燃烧热相差:2877.0kJ/mol-2219.9kJ/mol=657.1kJ/mol,
戊烷与丁烷燃烧热相差:3536.2kJ/mol-2877.0kJ/mol=659.2kJ/mol,
己烷与戊烷燃烧热相差:4163.1kJ/mol-3536.2kJ/mol=626.9kJ/mol,
![]() =654kJ/mol,
=654kJ/mol,
烷烃分子中每增加一个CH2燃烧热平均增加654kJ/mol左右,
故答案为:烷烃分子中每增加一个CH2,,燃烧热平均增加654kJ/mol左右;
(4)根据(3)的近似规律可预测癸烷与己烷相差4个CH2,燃烧热约为4163.1kJ/mol+654kJ/mol×4=6779 kJ/mol
答案为:6779 kJ/mol


科目:高中化学 来源: 题型:
【题目】以含镍废硫酸盐(含 Ni2+ 、Fe2+ 、Cu2+ 、Co2+ 、A13+ 、Mn2+ 、Cr3+ 、Mg2+ 、Zn2+ 等)为原料制取NiSO4·6H2O 的工艺流程如下:
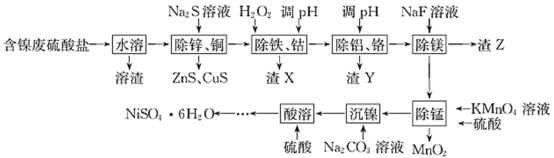
相关金属离子形成氢氧化物沉淀的pH 范围如下:
金属离子 | Co2+ | Co3+ | Fe2+ | Fe3+ | A13+ | Cr3+ | Ni2+ |
开始沉淀的pH | 7.2 | 0.23 | 6.3 | 1.5 | 4.1 | 4.3 | 6.9 |
沉淀完全的pH | 9.2 | 1.1 | 8.3 | 2.8 | 5.4 | 5.6 | 8.9 |
回答下列问题:
(1)已知1gKsp(CuS)= -47.6,1gKsp(ZnS)= -23.8,则反应ZnS+Cu2+![]() CuS+Zn2+的平衡常数对数值1gK= ________________________。
CuS+Zn2+的平衡常数对数值1gK= ________________________。
(2)“除铁、钴”时,加入H2O2的目的是 ______________,得到的渣X为________。
(3) “除铝、铬”时,调pH 范围为 _________;滤渣Y 中含Cr(OH)3,其性质与 A1(OH)3 类似,写出Cr(OH)3与NaOH反应的化学方程式: __________________。
(4)“除锰”时,发生反应的离子方程式为___________________________。
(5)“酸溶”得到溶液制备 NiSO4·6H2O晶体,还需进行的操作工艺是___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二甲醚和乙醇是两种常见的有机溶剂,也可作为新能源。
(1)通过以下反应可获得二甲醚(CH3OCH3):
①CO(g)+H2O(g)=CO2(g)+H2(g) ΔH 1=a kJ·molˉ1
②CO2(g)+3H2(g)=CH3OH(g)+H2O(g) ΔH 2=b kJ·molˉ1
③2CH3OH(g)=CH3OCH3(g)+H2O(g) ΔH 3=c kJ·molˉ1
则反应 2CO(g)+4H2(g)=CH3OCH3(g)+H2O(g)的 ΔH=_________kJ·molˉ1。
(2)已知气相直接水合法可以制取乙醇:H2O(g)+C2H4(g) ![]() CH3CH2OH(g)。
CH3CH2OH(g)。
在 n(H2O)∶n(C2H4)=1∶1 的条件下投料,乙烯的平衡转化率与温度(T)及压强(p) 的关系如图1所示。
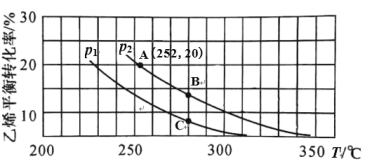 图1
图1
①下列有关说法中正确的是_________。
A.p1>p2 B.280℃时,vB>vC
C.A、B、C 三点的平衡常数 KA>KB>KC D.低温有利于该反应自发进行
②在 p2,280℃条件下,C 点的 v 正 ____v 逆 (填“>”、“<”或“=”),理由是________。
③计算图 1 中 A 点的平衡常数 Kp=_________。(结果用 p2 的代数式表示,平衡分压代替平衡浓度计算,分压=总压×物质的量分数)
(3)在 n(H2O)∶n(C2H4)=1∶x 的条件下投料,某研究小组在压强为 p2,温度为 252℃ 时,进行平衡体系中乙醇的体积分数随投料比变化的测定实验。在图 2 中画出平衡体系中乙醇的体积分数 φ 随 x 变化的示意图____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列热化学方程式或离子方程式中,正确的是
A. 0.01mol·L﹣1NH4Al(SO4)2溶液与0.02mol·L﹣1Ba(OH)2溶液等体积混合:NH4++Al3++2SO42﹣+2Ba2++4OH﹣═2BaSO4↓+Al(OH)3↓+NH3·H2O
B. 一定条件下,将0.5mol N2(g)和1.5molH2(g)置于密闭的容器中充分反应生成NH3(g),放热19.3kJ,其热化学方程式为:N2(g)+3H2(g)![]() 2NH3(g)△H=﹣38.6kJ·mol﹣1
2NH3(g)△H=﹣38.6kJ·mol﹣1
C. H2(g)+![]() O2(g)═H2O(g)△H=﹣285.8kJ·mol﹣1,则H2的燃烧热为285.8 kJ·mol﹣1
O2(g)═H2O(g)△H=﹣285.8kJ·mol﹣1,则H2的燃烧热为285.8 kJ·mol﹣1
D. CO(g)的燃烧热是283.0 kJ·mol﹣1,则CO2分解的热化学方程式为:2CO2(g)═2CO(g)+O2(g)△H=+283.0 kJ·mol﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在压强为0.1MPa条件下,容积为V L的密闭容器中a mol CO与2a mol H2在催化剂作用下反应生成甲醇:CO(g)+2H2(g)![]() CH3OH(g),CO的平衡转化率与温度、压强的关系如下图所示,则:
CH3OH(g),CO的平衡转化率与温度、压强的关系如下图所示,则:
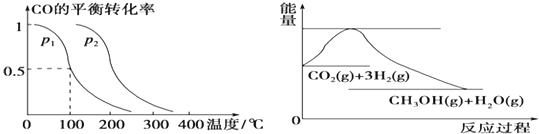
(1)①p1________p2(填“>”、“<”或“=”)。
②在其他条件不变的情况下,向容器中再增加a mol CO与2a mol H2,达到新平衡时,CO的平衡转化率________(填“增大”、“减小”或“不变”)。
③在p1下,100℃时,CO(g)+2H2(g)![]() CH3OH(g)反应的平衡常数为______(用含a、V的代数式表示)。
CH3OH(g)反应的平衡常数为______(用含a、V的代数式表示)。
(2)上图表示CO2与H2反应生成CH3OH和H2O的过程中能量(单位为kJmol﹣1)的变化,该反应的△H_________0,△S_______0。
(3)为探究反应原理,现进行如下实验,在体积为1L的密闭容器中,充入1mol CO2和3mol H2, 一定条件下发生反应:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g),测得CO2(g)和CH3OH(g)的浓度随时间变化的曲线如图所示:
CH3OH(g)+H2O(g),测得CO2(g)和CH3OH(g)的浓度随时间变化的曲线如图所示:
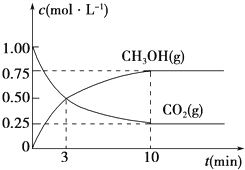
①从反应开始到平衡,CO2的平均反应速率v(CO2)=_________________________。
②下列措施中能使化学平衡向正反应方向移动的是________(填编号)。
A.升高温度
B.将CH3OH(g)及时液化移出
C.选择高效催化剂
D.再充入1mol CH3OH(g)和1mol H2O(g)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知甲、乙、丙、X是4种中学化学中常见的物质,其转化关系符合下图。则甲和X(要求甲和X能互换)不可能是
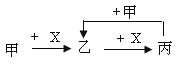
A.C和O2B.SO2 和NaOH溶液
C.Cl2和FeD.AlCl3溶液和NaOH溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,相同pH的盐酸和醋酸分别加水稀释至平衡,pH随溶液体积变化的曲线如下图所 示。据图判断正确的是
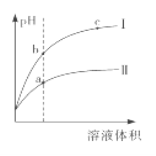
A. Ⅱ为盐酸稀释时的pH变化曲线
B. b点溶液的导电性比c点溶液的导电性强
C. a点KW的数值比c点KW的数值大
D. b点酸的总浓度大于a点酸的总浓度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学反应原理对化学反应的研究具有指导意义。
(1)机动车废气排放已成为城市大气污染的重要来源。
①气缸中生成NO的反应为:N2(g)+O2(g)![]() 2NO(g)△H>0。汽车启动后,气缸内温度越高,单位时间内NO排放量越大,请分析两点原因。A_____;B______。
2NO(g)△H>0。汽车启动后,气缸内温度越高,单位时间内NO排放量越大,请分析两点原因。A_____;B______。
②汽车汽油不完全燃烧时还产生CO,若设想按下列反应除去CO:2CO(g)=2C(s)+O2(g) △H>0,该设想能否实现?____(选填“能”或“不能”),依据是____。
(2)一定条件下,Fe3+和I﹣在水溶液中的反应是2I﹣+2Fe3+![]() I2+2Fe2+,当反应达到平衡后,加入CCl4充分振荡,且温度不变,上述平衡向____(选填“正反应”或“逆反应”)方向移动。请设计一种使该反应的化学平衡逆向移动的简单的实验方案____。
I2+2Fe2+,当反应达到平衡后,加入CCl4充分振荡,且温度不变,上述平衡向____(选填“正反应”或“逆反应”)方向移动。请设计一种使该反应的化学平衡逆向移动的简单的实验方案____。
(3)已知:①CH3OH(g)+![]() O2(g)=CO2(g)+2H2O(g) ΔH=-akJ·mol-1
O2(g)=CO2(g)+2H2O(g) ΔH=-akJ·mol-1
②CH4(g)+2O2(g)=CO2(g)+2H2O(g) ΔH=-bkJ·mol-1
③CH4(g)+2O2(g)=CO2(g)+2H2O(l) ΔH=-ckJ·mol-1
则下列叙述正确的是______
A.由上述热化学方程式可知b>c
B.甲烷的燃烧热为bkJ·mol-1
C.2CH3OH(g)=2CH4(g)+O2(g) ΔH=2(b-a)kJ·mol-1
D.若甲醇和甲烷的物质的量之比为1∶2,其完全燃烧生成CO2和H2O(l)时放出的热量为QkJ,则该混合物中甲醇的物质的量为![]() mol
mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验题
实验室制取乙烯是用乙醇跟浓硫酸反应,常因温度过高而发生副反应生成炭黑、二氧化硫、二氧化碳和水蒸气。请用如图编号为①~⑥的实验装置,设计一个实验,以验证上述反应后的混合气体中含有二氧化硫、二氧化碳和水蒸气。

(1)用装置的编号表示其连接顺序(按气体产物从左到右的流向)(6)→( )→(3)→( )→( )→( )____
(2)装置⑤中的固体药品为____,用以验证的产物是____。
(3)装置④中的溶液是____,用以验证的产物是____。
(4)装置①中的品红溶液的作用_____。
(5)装置②中溴水的作用是____。写出②中可能发生的2个化学方程式____、____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com