
【题目】在压强为0.1MPa条件下,容积为V L的密闭容器中a mol CO与2a mol H2在催化剂作用下反应生成甲醇:CO(g)+2H2(g)![]() CH3OH(g),CO的平衡转化率与温度、压强的关系如下图所示,则:
CH3OH(g),CO的平衡转化率与温度、压强的关系如下图所示,则:
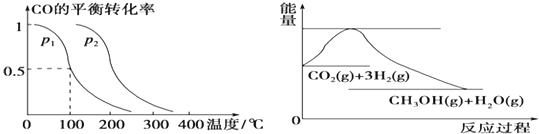
(1)①p1________p2(填“>”、“<”或“=”)。
②在其他条件不变的情况下,向容器中再增加a mol CO与2a mol H2,达到新平衡时,CO的平衡转化率________(填“增大”、“减小”或“不变”)。
③在p1下,100℃时,CO(g)+2H2(g)![]() CH3OH(g)反应的平衡常数为______(用含a、V的代数式表示)。
CH3OH(g)反应的平衡常数为______(用含a、V的代数式表示)。
(2)上图表示CO2与H2反应生成CH3OH和H2O的过程中能量(单位为kJmol﹣1)的变化,该反应的△H_________0,△S_______0。
(3)为探究反应原理,现进行如下实验,在体积为1L的密闭容器中,充入1mol CO2和3mol H2, 一定条件下发生反应:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g),测得CO2(g)和CH3OH(g)的浓度随时间变化的曲线如图所示:
CH3OH(g)+H2O(g),测得CO2(g)和CH3OH(g)的浓度随时间变化的曲线如图所示:
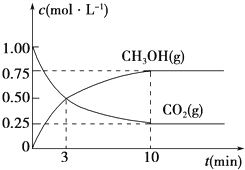
①从反应开始到平衡,CO2的平均反应速率v(CO2)=_________________________。
②下列措施中能使化学平衡向正反应方向移动的是________(填编号)。
A.升高温度
B.将CH3OH(g)及时液化移出
C.选择高效催化剂
D.再充入1mol CH3OH(g)和1mol H2O(g)
【答案】< 增大 ![]() < <
< < ![]() B
B
【解析】
(1)①采用“定一议二”法,固定同一温度,探究压强对CO转化率的影响即可分析得到结果;②温度容积不变,同等比例的增大反应物,相当于加压;据此作答;③用字母表示出物质的量浓度,代入平衡常数表达式即可计算出结果;
(2)生成物的总能量小于反应物的总能量则H<0,气体的物质的量减小的反应则熵变S<0,据此分析;
(3)①据图得到浓度变化量代入速率公式![]() 即可;
即可;
②根据勒夏特列原理,平衡总是向着减弱这种改变的方向移动,据此分析;
(1)①相同温度下,同一容器中,增大压强,平衡向正反应方向移动,则CO的转化率增大,根据图像可知,P1<P2,故答案为:<;
②温度容积不变,向该容器内再增加amolCO与2amol H2,等效为开始加入2amol CO与4a molH2,同等比例的增大反应物,相当于加压,增大压强,平衡向气体体积减小的方向移动,即向正反应方向移动,则CO的转化率增大;
故答案为:增大;
③该温度下,平衡时n(CO)=amol×(1-0.5)=0.5amol, n(CH3OH)= n(CO)(参加反应)=amol×0.5=0.5amol,n(H2)=2amol-2×amol×0.5=amol, ![]() 、
、![]() 、
、![]() ,化学平衡常数
,化学平衡常数 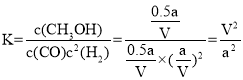 ;
;
故答案为:![]() ;
;
(2)由图可知,生成物的总能量小于反应物的总能量,因此,该反应的H<0;该反应为气体的物质的量减小的反应,因此其熵变S<0;
故答案为:<;<;
(3) ①![]() ,
,![]()
故答案为:![]() ;
;
②A.反应是放热反应,升温平衡逆向进行;故A错误;
B.将CH3OH(g)及时液化抽出,减少生成物的量,平衡正向进行,故B正确;
C.选择高效催化剂只能改变化学反应速率,不改变化学平衡,故C错误;
D.再充入1mol CH3OH(g)和1mol H2O(g),增大了生成物浓度,平衡逆向移动;
故答案为:B;


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】某固体样品可能含有Cu、SiO2、Fe2O3、Na2CO3、KAl(SO4)2、KNO3 中的若干种。为确定其组成,实验过程及产物如下:
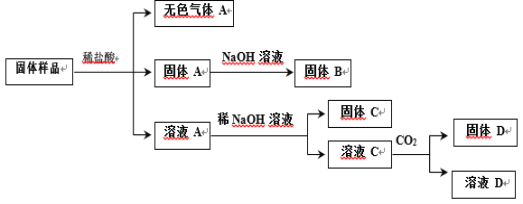
已知:①所用试剂均过量;②固体 B 的质量小于固体 A。下列说法正确的是
A.无色气体一定是纯净物
B.固体样品中一定有 Cu、Fe2O3、SiO2、Na2CO3
C.向溶液 A 加入足量浓氨水所得固体质量可能与固体 C 质量相等
D.向溶液 C 中通入 CO2 可改为进行焰色反应(透过蓝色钴玻璃片),不影响实验结论
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式书写正确的是( )
A.向溴水中通入SO2:SO2+2H2O+Br2=2H++SO42-+2HBr
B.碳酸氢钠溶液与足量的氢氧化钡溶液混合:HCO3-+Ba2++OH-=BaCO3↓+H2O
C.漂白粉溶液在空气中失效:2ClO-+CO2+H2O=2HClO+CO32-
D.实验室制氢氧化铁胶体:Fe3++3H2O![]() Fe(OH)3↓+3H+
Fe(OH)3↓+3H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳是形成化合物种类最多的元素,其单质及化合物是人类生产生活中的主要能源物质。请回答下列问题:
(1)有机物M经过太阳光光照可转化成N,转化过程如下:
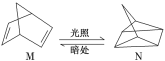
ΔH=+88.6 kJ/mol则M、N相比,较稳定的是_____________。
(2)已知CH3OH(l)的燃烧热ΔH=-238.6 kJ/mol,CH3OH(l)+12O2(g)=CO2(g)+2H2(g) ΔH=-a kJ/mol,则a________238.6(填“>”“<”或“=”)。
(3)将Cl2和H2O(g)通过灼热的炭层,生成HCl和CO2,当有1 mol Cl2参与反应时释放出145 kJ热量,写出该反应的热化学方程式:__________________________________。
(4)火箭和导弹表面的薄层是耐高温物质。将石墨、铝粉和二氧化钛按一定比例混合在高温下煅烧,所得物质可作耐高温材料,4Al(s)+3TiO2(s)+3C(s)=2Al2O3(s)+3TiC(s) ΔH=-1 176 kJ/mol,则反应过程中,每转移1 mol电子放出的热量为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.(1) SiH4是一种无色气体,遇到空气能发生爆炸性自燃,生成SiO2(s)和H2O(l)。已知室温下2 g SiH4自燃放出的热量为89.2 kJ,则其热化学方程式为: _____________________。
(2)沼气是一种能源,它的主要成分是CH4,其燃烧的热化学方程式为:CH4(g)+2O2(g) = CO2(g)+2H2O(l ) ΔH=-890 kJ/mol,又已知H2O(l)=H2O(g) ΔH=+44 kJ/mol,则11.2 L(标准状况)CH4完全燃烧生成气态水时放出的热量为_______________。
Ⅱ.已知下列几种烷烃的燃烧热如下:
烷烃 | 甲烷 | 乙烷 | 丙烷 | 丁烷 | 戊烷 | 己烷 |
燃烧热/ (kJ·mol-1) | 890.3 | 1559.8 | 2219.9 | 2877.0 | 3536.2 | 4163.1 |
今有10 L(标准状况下)某种天然气,假设仅含甲烷和乙烷两种气体,燃烧时共放出热量480 kJ。
(1)试写出乙烷气体燃烧的热化学方程式___________________________________。
(2)计算该天然气中甲烷的体积分数____________(保留小数点后两位)。
(3)由上表可总结出的近似规律是______________________________________________。
(4)根据(3)的近似规律可预测癸烷的燃烧热约为______kJ·mol-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实中,不能用勒夏特列原理解释的是
A. 冰镇的啤酒打开后泛起泡沫
B. 对N2+3H2![]() 2NH3的反应,使用铁触媒可加快合成氨反应的速率
2NH3的反应,使用铁触媒可加快合成氨反应的速率
C. 工业制取金属钾Na(l)+KCl(l)![]() NaCl(l)+K(g)选取适宜的温度,使K成蒸汽从反应混合物中分离出来
NaCl(l)+K(g)选取适宜的温度,使K成蒸汽从反应混合物中分离出来
D. 工业上生产硫酸的过程中使用过量的空气以提高二氧化硫的利用率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某校化学实验小组,为验证氯单质的氧化性强于硫和氮气,设计了一套实验装置:(部分夹持装置已略去)
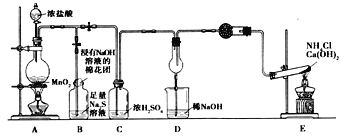
(1)写出A中反应的离子方程式_________。
(2)实验中证明氧化性Cl2>S的实验现象为___________。
(3)D干燥管中产生大量白烟,该反应的化学方程式为 ____________________。
(4)有同学认为从C排出的Cl2可能含有某杂质气体,影响D中现象的判断,该杂质气体是__________,若除去该杂质气体可以用___________溶液。
(5)E装置中反应的化学方程式为_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用分类法研究化学物质可系统、全面认识物质的性质。
I下列三组物质中,均有一种物质的类别与其他三种不同。
①MgO、![]() 、
、![]() 、CuO
、CuO
②HCl、![]() 、
、![]() 、
、![]()
③NaOH、![]() 、KOH、
、KOH、![]()
(1)三种物质依次是![]() 填化学式
填化学式![]() :
:
①______;②______;③______。
(2)这三种物质相互作用可生成一种新物质![]() ,该反应______
,该反应______![]() 填“是”或“不是”
填“是”或“不是”![]() 氧化还原反应。
氧化还原反应。
(3)写出![]() 与足量稀硫酸反应的离子方程式:______。
与足量稀硫酸反应的离子方程式:______。
(4)![]() 与
与![]() 、
、![]() 在溶液都不能大量共存,试用离子方程式说明:____________________________;________________________________________________
在溶液都不能大量共存,试用离子方程式说明:____________________________;________________________________________________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com