
【题目】某校化学实验小组,为验证氯单质的氧化性强于硫和氮气,设计了一套实验装置:(部分夹持装置已略去)
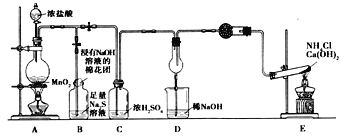
(1)写出A中反应的离子方程式_________。
(2)实验中证明氧化性Cl2>S的实验现象为___________。
(3)D干燥管中产生大量白烟,该反应的化学方程式为 ____________________。
(4)有同学认为从C排出的Cl2可能含有某杂质气体,影响D中现象的判断,该杂质气体是__________,若除去该杂质气体可以用___________溶液。
(5)E装置中反应的化学方程式为_______________________。
【答案】MnO2+4H++2Cl—![]() Mn2++Cl2↑+2H2O B中产生淡黄色沉定或B中溶液变浑浊 8NH3+3Cl2=6NH4Cl+N2 HCl 饱和食盐水 2NH4Cl+Ca(OH)2
Mn2++Cl2↑+2H2O B中产生淡黄色沉定或B中溶液变浑浊 8NH3+3Cl2=6NH4Cl+N2 HCl 饱和食盐水 2NH4Cl+Ca(OH)2![]() CaCl2+2NH3↑+2H2O
CaCl2+2NH3↑+2H2O
【解析】
(1)此反应装置为浓盐酸和二氧化锰共热制备氯气,以此写出离子方程式;
(2)B中出现黄色浑浊现象,说明有S沉淀生成,氯气的氧化性大于S的氧化性;
(3)装置E为实验室制取氨气的装置,氯气能把氨气氧化生成氮气和氯化氢,氯化氢与氨气反应生成氯化铵,故现象为冒白烟;
(4)浓盐酸易挥发,经过浓硫酸干燥的氯气中仍混有少量氯化氢气体,因此需要在C加一吸收装置,用饱和食盐水除掉氯化氢;
(5)氯化铵和氢氧化钙加热反应生成氨气。
(1)反应装置A为浓盐酸和二氧化锰共热制备氯气的装置,其离子方程式为:MnO2+4H++2Cl—![]() Mn2++Cl2↑+2H2O;
Mn2++Cl2↑+2H2O;
(2)反应制备的氯气通入B之后,B中出现黄色浑浊现象,说明氯气把硫化钠溶液中的硫离子氧化为S单质,离子方程式为Cl2+S2-=S↓+2Cl-;
(3)E装置是制备氨气,氯气能把氨气氧化生成氮气和氯化氢,生成的氯化氢和氨气结合生成氯化铵,从而冒白烟,因此实验的现象是产生大量白烟,反应的方程式是8NH3+3Cl2=6NH4Cl+N2;
(4)盐酸易挥发,生成的氯气中含有氯化氢气体,氯化氢也能直接和氨气结合冒白烟,所以需要在C之前连接一盛有饱和食盐水的装置以除去氯化氢气体;
(5)氯化铵和氢氧化钙固体加热反应生成氨气,反应的化学方程式为2NH4Cl+Ca(OH)2 ![]() CaCl2+2NH3↑+2H2O。
CaCl2+2NH3↑+2H2O。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】X、Y、Z、W有如图所示的转化关系,则X、Y可能是
①C,CO ②AlCl3、Al(OH)3 ③Na、Na2O ④NaOH、Na2CO3 ⑤AlO2-,Al(OH)3 ⑥Fe FeCl2
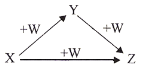
A.①②⑥B.①②③④⑤C.①②③④⑤⑥D.①②④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在压强为0.1MPa条件下,容积为V L的密闭容器中a mol CO与2a mol H2在催化剂作用下反应生成甲醇:CO(g)+2H2(g)![]() CH3OH(g),CO的平衡转化率与温度、压强的关系如下图所示,则:
CH3OH(g),CO的平衡转化率与温度、压强的关系如下图所示,则:
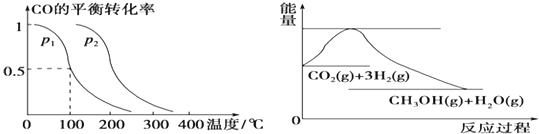
(1)①p1________p2(填“>”、“<”或“=”)。
②在其他条件不变的情况下,向容器中再增加a mol CO与2a mol H2,达到新平衡时,CO的平衡转化率________(填“增大”、“减小”或“不变”)。
③在p1下,100℃时,CO(g)+2H2(g)![]() CH3OH(g)反应的平衡常数为______(用含a、V的代数式表示)。
CH3OH(g)反应的平衡常数为______(用含a、V的代数式表示)。
(2)上图表示CO2与H2反应生成CH3OH和H2O的过程中能量(单位为kJmol﹣1)的变化,该反应的△H_________0,△S_______0。
(3)为探究反应原理,现进行如下实验,在体积为1L的密闭容器中,充入1mol CO2和3mol H2, 一定条件下发生反应:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g),测得CO2(g)和CH3OH(g)的浓度随时间变化的曲线如图所示:
CH3OH(g)+H2O(g),测得CO2(g)和CH3OH(g)的浓度随时间变化的曲线如图所示:
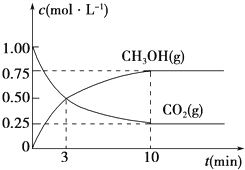
①从反应开始到平衡,CO2的平均反应速率v(CO2)=_________________________。
②下列措施中能使化学平衡向正反应方向移动的是________(填编号)。
A.升高温度
B.将CH3OH(g)及时液化移出
C.选择高效催化剂
D.再充入1mol CH3OH(g)和1mol H2O(g)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,相同pH的盐酸和醋酸分别加水稀释至平衡,pH随溶液体积变化的曲线如下图所 示。据图判断正确的是
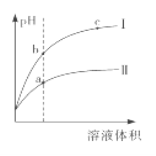
A. Ⅱ为盐酸稀释时的pH变化曲线
B. b点溶液的导电性比c点溶液的导电性强
C. a点KW的数值比c点KW的数值大
D. b点酸的总浓度大于a点酸的总浓度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列是有关外界条件对化学反应速率和化学平衡影响的图像,其中图像和实验结论表达均正确的是
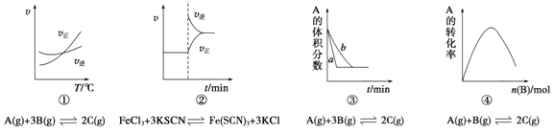
A. ①是其他条件一定时,反应速率随温度变化的图像,则正反应ΔH>0
B. ②是在平衡体系的溶液中溶入少量KCl晶体后,化学反应速率随时间变化的图像
C. ③是在有无催化剂存在条件下,建立平衡过程的图像,a是使用催化剂时的曲线
D. ④是一定条件下,向含有一定量A的恒容密闭容器中逐渐加入B,达平衡时A的转化率的图像
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学反应原理对化学反应的研究具有指导意义。
(1)机动车废气排放已成为城市大气污染的重要来源。
①气缸中生成NO的反应为:N2(g)+O2(g)![]() 2NO(g)△H>0。汽车启动后,气缸内温度越高,单位时间内NO排放量越大,请分析两点原因。A_____;B______。
2NO(g)△H>0。汽车启动后,气缸内温度越高,单位时间内NO排放量越大,请分析两点原因。A_____;B______。
②汽车汽油不完全燃烧时还产生CO,若设想按下列反应除去CO:2CO(g)=2C(s)+O2(g) △H>0,该设想能否实现?____(选填“能”或“不能”),依据是____。
(2)一定条件下,Fe3+和I﹣在水溶液中的反应是2I﹣+2Fe3+![]() I2+2Fe2+,当反应达到平衡后,加入CCl4充分振荡,且温度不变,上述平衡向____(选填“正反应”或“逆反应”)方向移动。请设计一种使该反应的化学平衡逆向移动的简单的实验方案____。
I2+2Fe2+,当反应达到平衡后,加入CCl4充分振荡,且温度不变,上述平衡向____(选填“正反应”或“逆反应”)方向移动。请设计一种使该反应的化学平衡逆向移动的简单的实验方案____。
(3)已知:①CH3OH(g)+![]() O2(g)=CO2(g)+2H2O(g) ΔH=-akJ·mol-1
O2(g)=CO2(g)+2H2O(g) ΔH=-akJ·mol-1
②CH4(g)+2O2(g)=CO2(g)+2H2O(g) ΔH=-bkJ·mol-1
③CH4(g)+2O2(g)=CO2(g)+2H2O(l) ΔH=-ckJ·mol-1
则下列叙述正确的是______
A.由上述热化学方程式可知b>c
B.甲烷的燃烧热为bkJ·mol-1
C.2CH3OH(g)=2CH4(g)+O2(g) ΔH=2(b-a)kJ·mol-1
D.若甲醇和甲烷的物质的量之比为1∶2,其完全燃烧生成CO2和H2O(l)时放出的热量为QkJ,则该混合物中甲醇的物质的量为![]() mol
mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锌及其化合物用途广泛。火法炼锌以闪锌矿(主要成分是ZnS)为主要原料,涉及的主要反应有:①2ZnS(s)+3O2(g)=2ZnO(s)+2SO2(g)△H1=﹣930kJmol-1
②2C(s)+O2(g)=2CO(g)△H2=﹣221kJmol-1
③ZnO(s)+CO(g)=Zn(g)+CO2(g)△H3=+198kJmol-1
(1)反应ZnS(s)+C(s)+2O2(g)=Zn(g)+CO2(g)+SO2(g)的△H4=____kJmol-1。
反应中生成的CO2与NH3混合,在一定条件下反应合成尿素:2NH3(g)+CO2(g)![]() CO(NH2)2(s)+H2O(g) △H。若该反应在一恒温、恒容密闭容器内进行,判断反应达到平衡状态的标志是___。
CO(NH2)2(s)+H2O(g) △H。若该反应在一恒温、恒容密闭容器内进行,判断反应达到平衡状态的标志是___。
a.CO2与H2O(g)浓度相等 b.容器中气体的压强不再改变
c.2v(NH3)正=v(H2O)逆 d.容器中混合气体的密度不再改变
(2)亚硝酰氯(NOCl)是有机合成中的重要试剂,可由NO与Cl2在一定条件下合成:2NO(g)+Cl2(g)![]() 2NOCl(g) △H<0。保持恒温恒容条件,将物质的量之和为3mol的NO和Cl2以不同的氮氯比[n(NO)/n(Cl2)]进行反应,平衡时某反应物的转化率与氮氯比及不同温度的关系如图所示:
2NOCl(g) △H<0。保持恒温恒容条件,将物质的量之和为3mol的NO和Cl2以不同的氮氯比[n(NO)/n(Cl2)]进行反应,平衡时某反应物的转化率与氮氯比及不同温度的关系如图所示:
①图中T1、T2的关系为:T1___T2(填“>”、“<”或“=”);
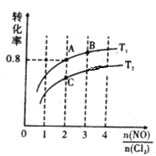
②图中纵坐标为物质___的转化率;
③图中A、B、C三点对应的NOCl体积分数最大的是____(填“A”、“B”、或“C”);
④若容器容积为2L,则B点的平衡常数的值为____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应属于氧化还原反应的是( )
A. SO3+ H2O= H2SO4 B. NH4Cl ![]() NH3
NH3![]() +HCl
+HCl![]()
C. Fe+CuSO4= FeSO4+Cu D. NaOH+HNO3=NaNO3+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:①I2(g)+H2(g)![]() 2HI(g)+26.5kJ、②I2(s)+H2(g)
2HI(g)+26.5kJ、②I2(s)+H2(g)![]() 2HI(g)-9.5kJ,下列分析正确的是
2HI(g)-9.5kJ,下列分析正确的是
A.①是放热反应,无需加热即可发生
B.②需持续不断加热才能发生反应
C.I2(g)和I2(s)的能量关系如图所示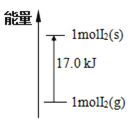
D.1molI2(s)和1molH2(g)的能量之和比2molHI(g)能量高
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com