
【题目】下列事实中,不能用勒夏特列原理解释的是
A. 冰镇的啤酒打开后泛起泡沫
B. 对N2+3H2![]() 2NH3的反应,使用铁触媒可加快合成氨反应的速率
2NH3的反应,使用铁触媒可加快合成氨反应的速率
C. 工业制取金属钾Na(l)+KCl(l)![]() NaCl(l)+K(g)选取适宜的温度,使K成蒸汽从反应混合物中分离出来
NaCl(l)+K(g)选取适宜的温度,使K成蒸汽从反应混合物中分离出来
D. 工业上生产硫酸的过程中使用过量的空气以提高二氧化硫的利用率
 金钥匙试卷系列答案
金钥匙试卷系列答案科目:高中化学 来源: 题型:
【题目】利用如图所示装置,当X、Y选用不同材料时,可将电解原理广泛应用于工业生产。下列说法中正确的是
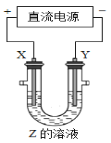
A. 氯碱工业中,X、Y均为石墨,Y附近能得到氢氧化钠
B. 铜的精炼中,X是纯铜,Y是粗铜,Z是CuSO4
C. 电镀工业中,X是待镀金属,Y是镀层金属
D. 外加电流的阴极保护法中,X是待保护金属
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某兴趣小组用白云石(主要含CaCO3 和MgCO3)和废铝屑制备一种化合物12CaO·7Al2O3。
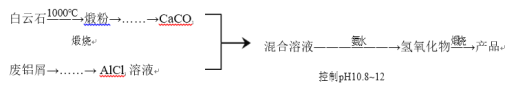
相关信息如下:
①MgCO3 分解温度低于 CaCO3;
②金属离子形成氢氧化物沉淀的 pH 范围:
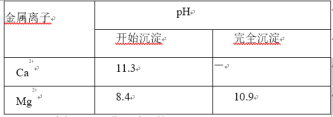
③AlCl3 易水解,易升华。请回答:
(1)从煅粉经一系列操作可制备纯净的CaCO3。请给出合理的操作排序(从下列操作中选取,按先后次序列出字母) :________
煅粉→加入适量 NH4NO3 溶液→( )→( )→( )→通入 NH3 和 CO2,控制pH<11.0→过滤→洗涤→CaCO3
a.过滤 b.控制 pH=11.0 c.控制 pH=8.0 d.取滤渣加水形成悬浊液 e.取滤液
(2)煅粉加入 NH4NO3 溶液发生反应的离子方程式是_________。
(3)通入 NH3 和 CO2 时,需控制 pH<11.0 的原因是_________。
(4)下列说法正确的是_________。
A.煅烧时,需用玻璃棒不断搅拌坩埚中固体,使其受热均匀
B.煅烧时产生 CO2 的体积恰好等于制备 CaCO3 时需要通入 CO2 的体积(已换算为相同状况)
C.NH4NO3 溶液还可用(NH4)2SO4、NH4HCO3 等溶液代替
D.过滤时,应选用玻璃砂漏斗,以免滤纸被溶液腐蚀
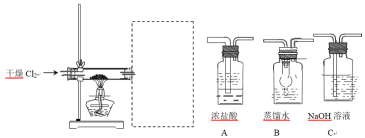
(5)废铝屑需要先放在乙醇和丙酮混合溶液中,放入超声波清洗器中清洗 30 分钟,目的是 __。取出晾干,用以下装置制备 AlCl3 溶液。请为虚线框中补充必须的装置,并按连接顺序排列 ___(填写代表装置的字母,不考虑橡皮管连接)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在压强为0.1MPa条件下,容积为V L的密闭容器中a mol CO与2a mol H2在催化剂作用下反应生成甲醇:CO(g)+2H2(g)![]() CH3OH(g),CO的平衡转化率与温度、压强的关系如下图所示,则:
CH3OH(g),CO的平衡转化率与温度、压强的关系如下图所示,则:
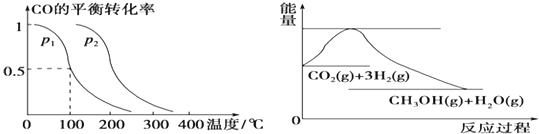
(1)①p1________p2(填“>”、“<”或“=”)。
②在其他条件不变的情况下,向容器中再增加a mol CO与2a mol H2,达到新平衡时,CO的平衡转化率________(填“增大”、“减小”或“不变”)。
③在p1下,100℃时,CO(g)+2H2(g)![]() CH3OH(g)反应的平衡常数为______(用含a、V的代数式表示)。
CH3OH(g)反应的平衡常数为______(用含a、V的代数式表示)。
(2)上图表示CO2与H2反应生成CH3OH和H2O的过程中能量(单位为kJmol﹣1)的变化,该反应的△H_________0,△S_______0。
(3)为探究反应原理,现进行如下实验,在体积为1L的密闭容器中,充入1mol CO2和3mol H2, 一定条件下发生反应:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g),测得CO2(g)和CH3OH(g)的浓度随时间变化的曲线如图所示:
CH3OH(g)+H2O(g),测得CO2(g)和CH3OH(g)的浓度随时间变化的曲线如图所示:
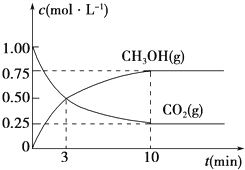
①从反应开始到平衡,CO2的平均反应速率v(CO2)=_________________________。
②下列措施中能使化学平衡向正反应方向移动的是________(填编号)。
A.升高温度
B.将CH3OH(g)及时液化移出
C.选择高效催化剂
D.再充入1mol CH3OH(g)和1mol H2O(g)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的值。下列叙述正确的是( )
A.1mol NH4+中含有的电子数为11 NA
B.0.1mol·L-1的Ba(OH)2溶液中含有的OH- 数目为0.2NA
C.0.1NA个氯分子溶于1L水中,所得溶液中c(C1-)=0.1mol·L-1
D.1mol NH3溶于水中配成1L溶液,所得氨水的物质的量浓度为1mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,相同pH的盐酸和醋酸分别加水稀释至平衡,pH随溶液体积变化的曲线如下图所 示。据图判断正确的是
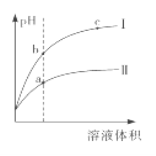
A. Ⅱ为盐酸稀释时的pH变化曲线
B. b点溶液的导电性比c点溶液的导电性强
C. a点KW的数值比c点KW的数值大
D. b点酸的总浓度大于a点酸的总浓度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列是有关外界条件对化学反应速率和化学平衡影响的图像,其中图像和实验结论表达均正确的是
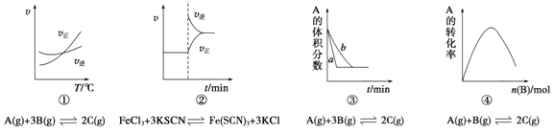
A. ①是其他条件一定时,反应速率随温度变化的图像,则正反应ΔH>0
B. ②是在平衡体系的溶液中溶入少量KCl晶体后,化学反应速率随时间变化的图像
C. ③是在有无催化剂存在条件下,建立平衡过程的图像,a是使用催化剂时的曲线
D. ④是一定条件下,向含有一定量A的恒容密闭容器中逐渐加入B,达平衡时A的转化率的图像
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锌及其化合物用途广泛。火法炼锌以闪锌矿(主要成分是ZnS)为主要原料,涉及的主要反应有:①2ZnS(s)+3O2(g)=2ZnO(s)+2SO2(g)△H1=﹣930kJmol-1
②2C(s)+O2(g)=2CO(g)△H2=﹣221kJmol-1
③ZnO(s)+CO(g)=Zn(g)+CO2(g)△H3=+198kJmol-1
(1)反应ZnS(s)+C(s)+2O2(g)=Zn(g)+CO2(g)+SO2(g)的△H4=____kJmol-1。
反应中生成的CO2与NH3混合,在一定条件下反应合成尿素:2NH3(g)+CO2(g)![]() CO(NH2)2(s)+H2O(g) △H。若该反应在一恒温、恒容密闭容器内进行,判断反应达到平衡状态的标志是___。
CO(NH2)2(s)+H2O(g) △H。若该反应在一恒温、恒容密闭容器内进行,判断反应达到平衡状态的标志是___。
a.CO2与H2O(g)浓度相等 b.容器中气体的压强不再改变
c.2v(NH3)正=v(H2O)逆 d.容器中混合气体的密度不再改变
(2)亚硝酰氯(NOCl)是有机合成中的重要试剂,可由NO与Cl2在一定条件下合成:2NO(g)+Cl2(g)![]() 2NOCl(g) △H<0。保持恒温恒容条件,将物质的量之和为3mol的NO和Cl2以不同的氮氯比[n(NO)/n(Cl2)]进行反应,平衡时某反应物的转化率与氮氯比及不同温度的关系如图所示:
2NOCl(g) △H<0。保持恒温恒容条件,将物质的量之和为3mol的NO和Cl2以不同的氮氯比[n(NO)/n(Cl2)]进行反应,平衡时某反应物的转化率与氮氯比及不同温度的关系如图所示:
①图中T1、T2的关系为:T1___T2(填“>”、“<”或“=”);
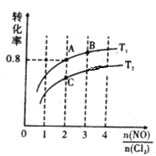
②图中纵坐标为物质___的转化率;
③图中A、B、C三点对应的NOCl体积分数最大的是____(填“A”、“B”、或“C”);
④若容器容积为2L,则B点的平衡常数的值为____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】网络表情包“苯宝宝装纯(醇)”,该分子由“苯宝宝”拿一个氢原子换了个羟基形成,下列说法不正确的是
A. 苯宝宝只想安静地装醇,说明该分子不是醇
B. 该分子中所有原子一定共面
C. 该分子能和Na发生置换反应生成H2
D. 该分子苯环上的一个氢原子被-C4H9取代所得的同分异构体有12种
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com