
【题目】常用解热镇痛药对乙酰氨基苯酚(扑热息痛)为白色颗粒状晶体,易被空气氧化。实验室用对氨基苯酚乙酰化制备扑热息痛的一种方法如下:

查阅资料获得以下数据:
对氨基苯酚 | 醋酸酐 | 对乙酰氨基苯酚 | |
熔点/℃ | 189.6 ~ 190.2 | -73 | 169 ~ 171 |
密度/g·cm-3 | 1.2 | 1.1 | 1.3 |
相对分子质量 | 109 | 102 | 151 |
溶解性 | 溶于乙醇和水 | 溶于乙醇, 稍溶于水 | 易溶于乙醇和热水,溶于丙酮 |

实验过程:如图所示,在三颈烧瓶中加入对氨基苯酚10.9g,再加入30 mL水。打开仪器a下端的旋塞,缓慢滴加12 mL醋酸酐。搅拌并水浴加热,控制温度在80℃左右,充分反应后按如下流程进行操作。

回答下列问题:
(1)仪器a的名称是___________,仪器b的作用是_____________。
(2)步骤②洗涤晶体获得粗品时,选择的洗涤剂是______。(填标号)
A.乙醇 B.丙酮 C.热水 D.冷水
(3)减压过滤装置如图所示。步骤④减压过滤时,在吸滤瓶中要先加入适量NaHSO3,其作用是_________,该减压过滤需趁热进行,原因是_____________。

(4)步骤⑥中操作X为_______________。
(5)若最终得到9.8 g对乙酰氨基苯酚,则本实验的产率为______%。(保留1位小数)
【答案】恒压滴液漏斗 冷凝回流醋酸酐 D 防止产品被氧化 冷却时产品会在布氏漏斗中结晶 洗涤、干燥 64.9
【解析】
实验过程:在三颈烧瓶中加入对氨基苯酚10.9g,再加入30 mL水,打开仪器a下端的旋塞,缓慢滴加12 mL醋酸酐,搅拌并水浴加热,控制温度在80℃左右,充分反应;对乙酰氨基苯酚易溶于热水,所以冷却后对乙酰氨基苯酚析出,过滤、用冷水洗涤得到粗品,之后再用热水溶解粗品,并加入活性炭吸附杂质同时防止产品被氧化,煮沸5min后趁热减压过滤,得到滤液,将滤液冷却结晶,减压过滤、洗涤干燥即可得到纯净的乙酰氨基苯酚。
(1)根据a的结构特点可知a为恒压滴液漏斗;醋酸酐熔沸点较低,加热反应过程中会造成大量挥发,装置b可以冷凝回流醋酸酐,提高原料的利用率;
(2)根据题目信息可知对乙酰氨基苯酚易溶于乙醇和热水,溶于丙酮,为降低产品的溶解损耗,应用冷水洗涤,所以选D;
(3)对乙酰氨基苯酚易被氧化,NaHSO3具有较强还原性,可以防止其被氧化;对乙酰氨基苯酚易溶于热水,冷却后会在布氏漏斗中结晶造成损耗;
(4)操作X应为洗涤、干燥;
(5)原料为对氨基苯酚10.9g,即0.1mol,12 mL醋酸酐即![]() =0.13mol,根据方程式可知理论上生成的对乙酰氨基苯酚应为0.1mol,实际得到9.8g产品,所以产率为
=0.13mol,根据方程式可知理论上生成的对乙酰氨基苯酚应为0.1mol,实际得到9.8g产品,所以产率为![]() =64.9%。
=64.9%。


科目:高中化学 来源: 题型:
【题目】某同学组装了如图所示的电化学装置。电极Ⅰ为Al,其他电极均为Cu,则下列说法正确的是
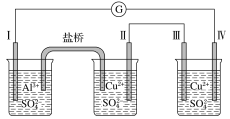
A. 电流方向:电极Ⅳ→![]() →电极Ⅰ
→电极Ⅰ
B. 电极Ⅰ发生还原反应
C. 电极Ⅱ逐渐溶解
D. 电极Ⅲ的电极反应:Cu2++2e-=Cu
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.白色无机盐 X(含三种元素,相对分子质量小于 400)能与水发生反应。为了探究 X 的组成,设计并完成了以下实验:
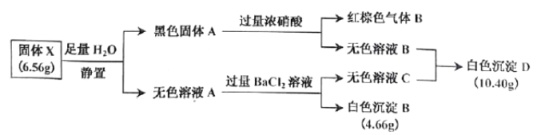
已知:白色沉淀 D 中的一种成分及质量与沉淀 B 相同。
(1)白色沉淀 D 的成分为_________(填写化学式)。
(2)黑色固体 A 与浓硝酸反应的离子方程式是_________。
(3)X 与 H2O 反应的化学方程式是_________。
Ⅱ.已知:①将 0.1 mol·Lˉ1KI 溶液加入到 0.1 mol·Lˉ1 FeCl3 溶液中时,可以看到溶液颜色加深,滴加淀粉后溶液变为蓝色;②当离子浓度相同时,氧化性:Ag+>Fe3+;③ 若浓度减小时,离子的氧化性也会随之减弱。
(1)甲同学猜测,0.1 mol·Lˉ1 KI 溶液(事先加入几滴淀粉溶液)加入到 0.1 mol·Lˉ1AgNO3 溶液中时,溶液应变蓝色。请写出该猜测对应的离子方程式_________。实 验结果未见到蓝色。
(2)乙同学认为甲同学的实验方案有问题,理由是_________。请你用原电池的方法证明Ag+也能氧化 Iˉ,要求画出实验装置图,并标明电极材料及电解质溶液 ________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外小组分别用下图所示装置对原电池和电解原理进行实验探究。
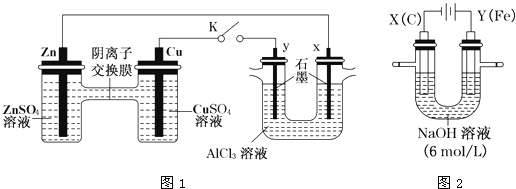
请回答:
Ⅰ.用图1所示装置进行第一组实验(K闭合)。
(1)Zn极为________极;实验过程中,SO42-____________(填“从左向右”、“从右向左”或“不”)移动。
(2)反应初期,y极的电极反应现象为________________;检验y极反应产物的方法是________________。
(3)Cu极的电极反应式为____________。
(4)Ⅱ.用图2所示装置进行第二组实验。实验过程中,两极均有气体产生,Y极区溶液逐渐变成紫红色;停止实验,铁电极明显变细,电解液仍然澄清。查阅资料发现,高铁酸根(FeO42-)在溶液中呈紫红色。电解过程中,X极的电极反应式为__________。
(5)电解过程中,Y极发生的电极反应为Fe-6e-+8OH-=FeO42-+4H2O和4OH--4e-=2H2O+O2↑,若在X极收集到672mL气体,在Y极收集到168mL气体(均已折算为标准状况时气体体积),则Y电极(铁电极)质量减少________g。
(6)在碱性锌电池中,用高铁酸钾作为正极材料,电池反应为:2K2FeO4+3Zn=Fe2O3+ZnO+2K2ZnO2该电池正极发生反应的电极反应式为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知甲、乙、丙、X是4种中学化学中常见的物质,其转化关系符合下图。则甲和X(要求甲和X能互换)不可能是
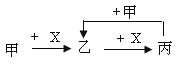
A.C和O2B.SO2 和NaOH溶液
C.Cl2和FeD.AlCl3溶液和NaOH溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于氧化还原反应的叙述中,正确的是( )
A.有单质参加的反应一定是氧化还原反应
B.燃烧反应必须有氧气作氧化剂
C.2Fe+3Cl2![]() 2FeCl3; Fe+S
2FeCl3; Fe+S![]() FeS 由此可以判断氧化性:Cl2>S
FeS 由此可以判断氧化性:Cl2>S
D.Mg在化学反应中失去2个电子,而Al在化学反应中失去3个电子,因此还原性Al>Mg
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】阅读下面的信息,推断元素及有关物质,按要求回答问题:
信息①:X、Y、Z、W是常见的短周期元素,其原子序数依次增大,且原子核外最外层电子数均不少于2。(1)根据信息①,X一定不是_________(填序号)。
A.氢 B. 碳 C. 氧 D. 硫
信息②:上述四种元素的单质均能在足量的氧气中燃烧,生成的四种氧化物中,有两种能溶于稀硫酸,三种能溶于浓氢氧化钠溶液,氧化物的相对分子质量都大于26。
(2)这四种元素中是否可能有一种是铝元素?______。
信息③:向上述四种元素单质组成的混合物中加入足量盐酸溶液,固体部分溶解,过滤,向滤液中加入过量的烧碱溶液,最终溶液中析出白色沉淀。
(3)白色沉淀物的化学式为___________。
信息④:向上述四种元素单质组成的混合物中加入足量烧碱溶液,固体部分溶解,过滤,向滤液中加入过量的盐酸溶液,最终溶液中析出白色沉淀。
(4)析出白色沉淀的离子方程式为__________________________。
信息⑤:X与W同主族
(5)X与浓硫酸加热时反应的化学方程式为___;Y在X的氧化物中能剧烈燃烧,其反应现象为__。
(6)已知H![]() 的燃烧热为285.8 kJ/mol。现有X的氢化物XH4和H2的混合气体各0.1mol,与O
的燃烧热为285.8 kJ/mol。现有X的氢化物XH4和H2的混合气体各0.1mol,与O![]() 完全燃烧生成H2O(1)时,放出的热量为117.6kJ。则XH4完全燃烧的热化学反应方程式为:________。
完全燃烧生成H2O(1)时,放出的热量为117.6kJ。则XH4完全燃烧的热化学反应方程式为:________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向20 mL浓度均为0.1 mol/LHX 和CH3COOH的混合液中滴加0.1 mol·L-1的NH3·H2O,测得混合液的电阻率与加入NH3·H2O 的体积(V)的关系如图所示。已知:物质的电阻率越大,导电能力越弱,CH3COOH的![]() ,NH3·H2O的
,NH3·H2O的![]() 。下列说法错误的是
。下列说法错误的是

A.常温时,0.1 mol/LHX的pH比0.1 mol/LCH3COOH 的pH小
B.a→c过程中水的电离程度先增大后减小
C.c点溶液中:c(CH3COO-)+c(X-)>c(NH4+)
D.d 点有4c(NH4+)+4c(NH3·H2O)=0.3mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示为实验室常用装置。回答下列问题:
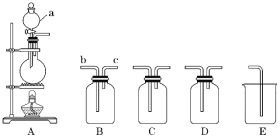
(1)仪器a的名称为____。
(2)利用二氧化锰与浓盐酸反应制备并收集Cl2时,依次连接装置 A、B、C、D、E并加入适当的 试剂。装置B中饱和食盐水的作用是____;利用装置C干燥Cl2,选用的试剂是____;装置E的作用是____。
(3)利用铜和稀硝酸反应制备并收集NO时,连接装置A、B、E并加入适 当的试剂。A中反应的离子方程式为____,A中导气管应连接B的___(填“b”或“c”)端。实验过程中观察到A中出现了红棕色,但收集的气体为无色,原因是____(用化学方程式表示)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com