
【题目】如图所示为实验室常用装置。回答下列问题:
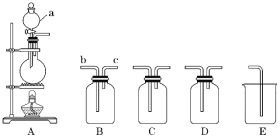
(1)仪器a的名称为____。
(2)利用二氧化锰与浓盐酸反应制备并收集Cl2时,依次连接装置 A、B、C、D、E并加入适当的 试剂。装置B中饱和食盐水的作用是____;利用装置C干燥Cl2,选用的试剂是____;装置E的作用是____。
(3)利用铜和稀硝酸反应制备并收集NO时,连接装置A、B、E并加入适 当的试剂。A中反应的离子方程式为____,A中导气管应连接B的___(填“b”或“c”)端。实验过程中观察到A中出现了红棕色,但收集的气体为无色,原因是____(用化学方程式表示)。
【答案】分液漏斗 吸收HCl气体 浓硫酸 吸收Cl2 3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O c 2NO+O2=2NO2,3NO2+H2O=NO+2HNO3
【解析】
(1)仪器a为分液漏斗;
(2)考查实验室制备Cl2,并收集该气体;
(3)考查实验室制备NO,并收集该气体,需要注意的是,一般使用排水法收集NO。
(1)仪器a为分液漏斗;
(2)实验室制备Cl2,B中装有饱和食盐水,其作用是吸收逸出的HCl气体;C为干燥装置,需要使用浓硫酸;D为收集装置,E为尾气处理装置,用来吸收Cl2;
(3)实验室制备NO,一般使用Cu和稀HNO3,反应的离子方程式为:3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O;收集时由于NO对空气不稳定,一般使用排水法收集,故B中应是装满水的,则A中导气管应连接B的c端;实验过程中观察到A中出现了红棕色,是因为2NO+O2=2NO2,收集的气体为无色,是因为3NO2+H2O=NO+2HNO3。


科目:高中化学 来源: 题型:
【题目】常用解热镇痛药对乙酰氨基苯酚(扑热息痛)为白色颗粒状晶体,易被空气氧化。实验室用对氨基苯酚乙酰化制备扑热息痛的一种方法如下:

查阅资料获得以下数据:
对氨基苯酚 | 醋酸酐 | 对乙酰氨基苯酚 | |
熔点/℃ | 189.6 ~ 190.2 | -73 | 169 ~ 171 |
密度/g·cm-3 | 1.2 | 1.1 | 1.3 |
相对分子质量 | 109 | 102 | 151 |
溶解性 | 溶于乙醇和水 | 溶于乙醇, 稍溶于水 | 易溶于乙醇和热水,溶于丙酮 |

实验过程:如图所示,在三颈烧瓶中加入对氨基苯酚10.9g,再加入30 mL水。打开仪器a下端的旋塞,缓慢滴加12 mL醋酸酐。搅拌并水浴加热,控制温度在80℃左右,充分反应后按如下流程进行操作。

回答下列问题:
(1)仪器a的名称是___________,仪器b的作用是_____________。
(2)步骤②洗涤晶体获得粗品时,选择的洗涤剂是______。(填标号)
A.乙醇 B.丙酮 C.热水 D.冷水
(3)减压过滤装置如图所示。步骤④减压过滤时,在吸滤瓶中要先加入适量NaHSO3,其作用是_________,该减压过滤需趁热进行,原因是_____________。

(4)步骤⑥中操作X为_______________。
(5)若最终得到9.8 g对乙酰氨基苯酚,则本实验的产率为______%。(保留1位小数)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】近日某著名白酒生产企业又陷入“塑化剂”事件。据称“塑化剂”大量超标的白酒被人饮用后,可引起肝癌。常见的塑化剂DEHP分子结构如下:关于该塑化剂的说法错误的是 ( )

A. 塑化剂DEHP分子中含有碳、氢和氧三种元素
B. 塑化剂DEHP分子中至少含有两种官能团
C. 塑化剂DEHP分子易溶于酒精
D. 塑化剂DEHP分子可发生取代反应 加成反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)根据反应![]() ,回答下列问题:
,回答下列问题:
①用双线桥法标出该反应中电子转移的方向和数目:______。
②该反应中______元素被还原,______元素被氧化。
③在该反应中,若有![]() 电子发生转移,在标准状况下,可生成
电子发生转移,在标准状况下,可生成![]() 的体积为_____L。
的体积为_____L。
(2)配平化学方程式且回答下列问题:
①______ ![]() ______
______![]() ___
___![]() _____
_____![]() ___ Cl2 ___H2O
___ Cl2 ___H2O
②若生成![]() ,则被氧化的HCl是_________mol,
,则被氧化的HCl是_________mol,
(3)已知反应:2H2S+H2SO3=2H2O +3S,若氧化产物比还原产物多![]() ,则同时会生成水的质量为 ______ g。
,则同时会生成水的质量为 ______ g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定量的Cu粉与浓H2SO4共热产生SO2气体的体积为2.24 L(标准状况下),则下列情况不可能的是( )
A.加入Cu的质量为6.4 g
B.加入的浓H2SO4中含溶质0.2 mol
C.加入Cu的质量大于6.4 g
D.加入浓H2SO4中含溶质多于0.2 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】环己烯是重要的有机合成原料,常用作高辛烷值汽油稳定剂。其实验室制备流程如下:
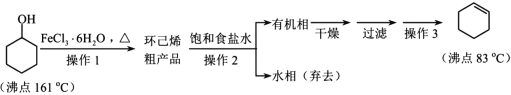
请回答下列问题:
(1)实验室用FeCl3 溶液制备 FeCl3·6H2O 的方法是__________。
(2)操作 1 的装置如图所示(加热和夹持装置已略去)。
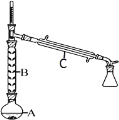
①仪器B的作用为_________。
②烧瓶A中进行的可逆反应化学方程式为_______
(3)浓硫酸也可作该反应的催化剂,选择 FeCl3·6H2O 而不用浓硫酸的原因为________(填选项)。
A.浓硫酸易使原料碳化并产生 SO2
B.FeCl3·6H2O 污染小、可循环使用,符合绿色化学理念
C.同等条件下,用 FeCl3·6H2O 比浓硫酸的平衡转化率高
(4)操作2用到的玻璃仪器是____________。
(5)环己烯含量的测定:在一定条件下,向 a g 环己烯样品中加入定量制得的b mol Br2, 与环己烯充分反应后,剩余的 Br2 与 足 量 KI 作用生成 I2 ,用 c molL-1 的 Na2S2O3标准溶液滴定,终点时消耗 Na2S2O3 标准溶液 v ml(以上数据均已扣除干扰因素)。测定过程中,发生的反应如下:
①![]() +Br2→
+Br2→![]()
② Br2+ KI=I2 + 2KBr
③ I2 + 2Na2S2O3=2 NaI+ Na2S4O6
滴定所用指示剂为_____________________ ;样品中环己烯的质量分数为_________________(用字母表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是家用消毒液发生器,下列分析错误的是

A.碳棒a是阴极
B.反应中碳棒b附近溶液显酸性
C.电子由碳棒a经溶液流向碳棒b
D.发生器中的总反应:NaCl+H2O![]() NaClO+H2↑
NaClO+H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】0.1mol某有机物的蒸气跟过量O2混合后点燃,生成13.2g CO2和5.4g H2O,该有机物跟金属反应放出H2,又能跟新制Cu(OH)2悬浊液加热时生成红色沉淀,此有机物还能跟乙酸反应生成酯类化合物.该酯类化合物的结构简式可能是( )
A. CH3CH(OCH3) CHOB. OHCCH2CH2COOCH3
C. CH3CH(OOCCH3)CHOD. OHCCH(OH) COOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以粉煤灰(主要成分:Al2O3、SiO2、少量Fe2O3)为原料,制取Al2O3的部分工艺流程如下:

完成下列填空:
(1)铝原子核外有_____种不同能量的电子,最外层电子的轨道式是_____________,上述流程涉及第二周期元素的原子半径由小到大的顺序是______________________________。
(2) “除铁”是将Fe3+转化为Fe(OH)3沉淀,反应的离子方程式为______________________,检验溶液中Fe3+是否除尽的方法是____________________________________________。
(3)解释“结晶”过程中向AlCl3浓溶液中通入HCl气体的原因。______________________
(4)上述流程可循环的物质是_______________。
(5)工业上将Al2O3溶解在熔化的冰晶石中电解获得铝,该反应的化学方程式为___________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com