
【题目】0.1mol某有机物的蒸气跟过量O2混合后点燃,生成13.2g CO2和5.4g H2O,该有机物跟金属反应放出H2,又能跟新制Cu(OH)2悬浊液加热时生成红色沉淀,此有机物还能跟乙酸反应生成酯类化合物.该酯类化合物的结构简式可能是( )
A. CH3CH(OCH3) CHOB. OHCCH2CH2COOCH3
C. CH3CH(OOCCH3)CHOD. OHCCH(OH) COOH
【答案】C
【解析】
0.1mol某有机物的蒸气跟足量O2混合点燃,反应后生成13.2g即0.3molCO2和5.4g即0.3molH2O,根据质量守恒可知1个有机物分子中含有3个碳原子和6个氢原子,可能含有氧原子,根据该有机物能跟Na反应放出H2,又能跟新制Cu(OH)2反应生成红色沉淀,此有机物还能跟乙酸反应生成酯类化合物,说明有机物中一定含有羟基、醛基,可能含有羧基,生成的酯类化合物中一定含有酯基来解答。
A.CH3-CH(OCH3)-CHO中没有酯基,不符合题意,故A错误;
B.OHCCH2COOCH2CH3中含有酯基,但原有机物中没有羟基,不符合题意,故B错误;
C.![]() 中含有酯基,原有机物中1个分子中含有3个碳原子和6个氢原子,有机物中含有羟基、醛基,符合题意,故C正确;
中含有酯基,原有机物中1个分子中含有3个碳原子和6个氢原子,有机物中含有羟基、醛基,符合题意,故C正确;
D.CH3COOCH2CH2COCH3中没有醛基,不符合题意,故D错误;
故答案为C。


 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案科目:高中化学 来源: 题型:
【题目】常温下,向20 mL浓度均为0.1 mol/LHX 和CH3COOH的混合液中滴加0.1 mol·L-1的NH3·H2O,测得混合液的电阻率与加入NH3·H2O 的体积(V)的关系如图所示。已知:物质的电阻率越大,导电能力越弱,CH3COOH的![]() ,NH3·H2O的
,NH3·H2O的![]() 。下列说法错误的是
。下列说法错误的是

A.常温时,0.1 mol/LHX的pH比0.1 mol/LCH3COOH 的pH小
B.a→c过程中水的电离程度先增大后减小
C.c点溶液中:c(CH3COO-)+c(X-)>c(NH4+)
D.d 点有4c(NH4+)+4c(NH3·H2O)=0.3mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示为实验室常用装置。回答下列问题:
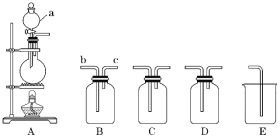
(1)仪器a的名称为____。
(2)利用二氧化锰与浓盐酸反应制备并收集Cl2时,依次连接装置 A、B、C、D、E并加入适当的 试剂。装置B中饱和食盐水的作用是____;利用装置C干燥Cl2,选用的试剂是____;装置E的作用是____。
(3)利用铜和稀硝酸反应制备并收集NO时,连接装置A、B、E并加入适 当的试剂。A中反应的离子方程式为____,A中导气管应连接B的___(填“b”或“c”)端。实验过程中观察到A中出现了红棕色,但收集的气体为无色,原因是____(用化学方程式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据要求答题
(一)现有下列七种物质:①铝 ②蔗糖 ③CO2 ④H2SO4 ⑤Ba(OH)2 ⑥红褐色的氢氧化铁胶体 ⑦HCl ⑧冰水混合物 ⑨碳酸钙 ⑩CuSO4·5H2O。
(1)上述物质中属于电解质的有__________(填序号)。
(2)向⑥的溶液中逐渐滴加⑦的溶液,看到的现象是________________________。
(3)上述物质中有两种物质在水溶液中发生反应,其离子方程式为:H++OH-=H2O,则该反应的化学方程式为______________________________。
(二)(1)某气态氧化物化学式为RO2,在标准状况下,1.28 g该氧化物的体积是448 mL,则氧化物的摩尔质量为_______,R的相对原子质量为__________。
(2)在标准状况下,w L氮气含有x个N2分子,则阿伏加德罗常数为____________(用w,x表示)。
(3)过滤后的食盐水仍含有可溶性的CaCl2、MgCl2、Na2SO4等杂质,通过如下几个实验步骤,可制得纯净的食盐水:①加入稍过量的BaCl2溶液;②加入稍过量的NaOH溶液;③加入稍过量的Na2CO3溶液;④滴入稀盐酸至无气泡产生;⑤过滤。正确的操作顺序是________(填写序号)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】汉黄芩素是传统中草药黄芩的有效成分之一,对肿瘤细胞的杀伤有独特作用。下列有关汉黄芩素的叙述正确的是( )
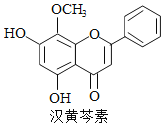
A. 汉黄芩素的分子式为C16H13O5
B. 该物质遇FeCl3溶液不显色
C. 1 mol该物质与溴水反应,最多消耗2 mol Br2
D. 与足量H2发生加成反应后,该分子中官能团的种类减少1种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在下图装置中,加热试管内的白色固体A(A的焰色反应为黄色),生成白色固体B并放出气体C和D,这些气体通过甲瓶的浓硫酸后,C被吸收;D进入乙瓶跟另一淡黄色固体E反应生成白色固体B和气体F;丙瓶中的NaOH溶液用来吸收剩余的气体D。
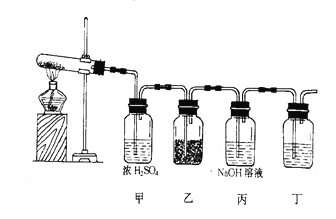
(1)写出各物质的化学式:
A______; B_______; C________; D______; E_______; F___________。
(2)写出试管中及丙瓶中反应的化学方程式:_______________;__________________。
(3)等物质的量A、B分别与足量的盐酸反应生成气体的体积________(填“一样多”、“前者多”、“后者多”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.N和Li、Na形成的Li3N、NaN3等化合物具有重要的用途。完成下列填空:
(1)氮原子核外能量最高的电子所处的轨道是:____________。锂离子核外电子的轨道表示式是:____________。
(2)已知Li3N熔点为845℃,NH3熔点﹣77.7℃,用物质结构的知识说明这两种含氮化合物熔点差异的可能原因____________。
II.研究者发明了利用锂循环合成氨的工艺,其流程如下:
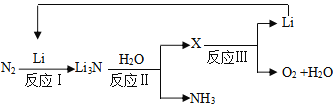
(3)每合成1mol氨,转移电子____________mol;该过程最终得到的氧化产物是____________。
(4)写出反应Ⅱ的化学反应方程式:____________。向0.35gLi3N中加入40mL1mol/L的盐酸,所得溶液中离子浓度由大到小的顺序是:____________。
(5)由元素周期律能得到____________(填序号)。
A.碱性:LiOH<NaOH B.与水反应的剧烈程度:Li<Na
C.溶解度:LiOH<NaOH D.密度:Li<Na
(6)NaN3可用于汽车安全气囊,冲撞时发生如下反应:□NaN3+□KNO3→□K2O+□Na2O+□N2↑,配平此反应的化学方程式,并标出电子转移的数目和方向。____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组利用NaI溶液中通入少量Cl2得到含碘废液,再利用含碘废液获取NaI固体,实验流程如下:

已知反应②:2I﹣+2Cu2++![]() +H2O
+H2O![]() 2CuI↓+
2CuI↓+![]() +2H+。
+2H+。
回答下列问题:
(1)过滤实验所需要的玻璃仪器有普通漏斗、烧杯、_____________。
(2)反应③中CuI被氧化,还原产物只有NO2,该反应的化学方程式为_________________。当有95.5 g CuI参与反应,则需要标况下______________L的O2才能将生成的NO2在水中完全转化为硝酸。
(3)化合物B中含两种元素,铁原子与另一种元素原子的物质的量之比为3∶8,则化合物B的化学式为_____________。
(4)反应⑤中生成黑色固体和无色气体,黑色固体的俗称为磁性氧化铁,则反应⑤的化学方程式为______。
(5)将足量的Cl2通入含12 g NaI的溶液中,一段时间后把溶液蒸干得到固体的质量为_________g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在高温下,Fe与水蒸气可发生反应。应用下列装置,就可以完成此反应的实验。

(1)仪器A的名称为____________;其底部放了几片碎瓷片,其作用是____________。
(2)实验前必须对整套装置进行的操作是_________________;实验开始时应先点燃_____(填“酒精灯”或“酒精喷灯”)。
(3)若反应生成的固体具有磁性,写出铁与水蒸气反应的化学方程式__________________。
(4)请写出在D处收集尾气的方法:___________________________;如果要在D处点燃尾气,则必须对该气体进行____________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com