
【题目】I.N和Li、Na形成的Li3N、NaN3等化合物具有重要的用途。完成下列填空:
(1)氮原子核外能量最高的电子所处的轨道是:____________。锂离子核外电子的轨道表示式是:____________。
(2)已知Li3N熔点为845℃,NH3熔点﹣77.7℃,用物质结构的知识说明这两种含氮化合物熔点差异的可能原因____________。
II.研究者发明了利用锂循环合成氨的工艺,其流程如下:
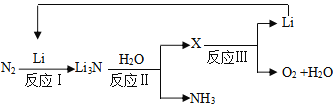
(3)每合成1mol氨,转移电子____________mol;该过程最终得到的氧化产物是____________。
(4)写出反应Ⅱ的化学反应方程式:____________。向0.35gLi3N中加入40mL1mol/L的盐酸,所得溶液中离子浓度由大到小的顺序是:____________。
(5)由元素周期律能得到____________(填序号)。
A.碱性:LiOH<NaOH B.与水反应的剧烈程度:Li<Na
C.溶解度:LiOH<NaOH D.密度:Li<Na
(6)NaN3可用于汽车安全气囊,冲撞时发生如下反应:□NaN3+□KNO3→□K2O+□Na2O+□N2↑,配平此反应的化学方程式,并标出电子转移的数目和方向。____________
【答案】2p ![]() Li3N是由活泼的金属和活泼的非金属形成的化合物,且其熔点为845℃,可推知Li3N可能为离子化合物,Li3N熔化需要破坏离子键,NH3是分子晶体,熔化破坏分子间作用力,离子键比分子间作用力强 3 O2 Li3N+3H2O→3LiOH+NH3↑ c(Cl﹣)>c(Li+)>c(NH4+)>c(H+)>c(OH﹣) AB
Li3N是由活泼的金属和活泼的非金属形成的化合物,且其熔点为845℃,可推知Li3N可能为离子化合物,Li3N熔化需要破坏离子键,NH3是分子晶体,熔化破坏分子间作用力,离子键比分子间作用力强 3 O2 Li3N+3H2O→3LiOH+NH3↑ c(Cl﹣)>c(Li+)>c(NH4+)>c(H+)>c(OH﹣) AB ![]()
【解析】
I.N和Li、Na形成的Li3N、NaN3等化合物具有重要的用途。
(1)氮原子核外电子所占据的轨道中,能量关系为1s<2s<2p,由此可得出能量最高的电子所处的轨道。锂离子核外电子排布式为1s2,由此可得出轨道表示式。
(2)已知Li3N熔点为845℃,NH3熔点﹣77.7℃,这两种含氮化合物熔点差异由其微粒间的作用力决定,分析二者所属晶体类型,便可找到原因。
II.在流程中,反应Ⅰ为N2与Li反应生成Li3N,反应Ⅱ为Li3N与H2O反应生成LiOH和NH3,反应Ⅲ为LiOH熔融电解生成Li、O2和H2O。
(3)合成氨时,N元素由0价降低到-3价,由此可求出转移电子数;该过程最终得到的氧化产物是含价态升高元素的产物。
(4)反应Ⅱ为Li3N与H2O反应生成LiOH和NH3,由此可写出化学反应方程式。0.35gLi3N为0.01mol,40mL1mol/L的盐酸为0.04mol,反应生成0.03molLiCl和0.01molNH4Cl,溶液中所含离子为Cl-、Li+、NH4+、H+、OH-,通过计算及分析可确定离子浓度由大到小的顺序。
(5)由元素周期律描述金属性、非金属性的递变规律、原子半径的递变规律、主要化合价的递变规律等,由此可作出判断。
(6)配平方程式□NaN3+□KNO3→□K2O+□Na2O+□N2↑,以NaN3、KNO3作为首先配平物质,利用得失电子守恒先进行配平,然后再利用质量守恒配平其它物质,由此可得出配平的化学方程式;电子转移的方向是从反应物中失电子元素指向得电子元素,数目为失电子总数或得电子总数。
(1)氮原子核外能量关系为1s<2s<2p,所以能量最高的电子所处的轨道是2p。锂离子核外电子只排布在1s轨道上,所以轨道表示式是![]() 。答案为:2p;
。答案为:2p;![]() ;
;
(2)已知Li3N熔点为845℃,NH3熔点﹣77.7℃,则表明Li3N晶体中微粒间的作用力大,而NH3晶体中微粒间的作用力小,分析二者的晶体类型,便可得出两种含氮化合物熔点差异的可能原因是:Li3N是由活泼的金属和活泼的非金属形成的化合物,且其熔点为845℃,可推知Li3N可能为离子化合物,Li3N熔化需要破坏离子键,NH3是分子晶体,熔化破坏分子间作用力,离子键比分子间作用力强;
(3)由以上分析知,合成氨时,N由0价降为-3价,则生成1mol氨,转移电子3mol;该过程发生的总反应为2N2+6H2O![]() 4NH3+3O2,最终得到的氧化产物是O2;
4NH3+3O2,最终得到的氧化产物是O2;
(4)反应Ⅱ为Li3N与H2O反应生成LiOH和NH3,化学反应方程式:Li3N+3H2O→3LiOH+NH3↑。0.35gLi3N为0.01mol,40mL1mol/L的盐酸为0.04mol,反应生成0.03molLiCl和0.01molNH4Cl,溶液中所含离子为Cl-、Li+、NH4+、H+、OH-,溶液中存在的水解和弱电解质电离方程式为NH3·H2O![]() NH4++OH-、H2O
NH4++OH-、H2OH++OH-,所得溶液中离子浓度由大到小的顺序是:c(Cl﹣)>c(Li+)>c(NH4+)>c(H+)>c(OH﹣);
(5)元素周期律描述金属性、非金属性的递变规律、原子半径的递变规律、主要化合价的递变规律等,金属性越强,金属与水反应置换出H2越容易,反应越剧烈,其最高价氧化物的水化物的碱性越强;没有涉及溶解度及密度的递变规律,则由元素周期律能得到AB;
(6)配平方程式□NaN3+□KNO3→□K2O+□Na2O+□N2↑,以NaN3、KNO3作为首先配平物质,即得10NaN3+2KNO3→□K2O+□Na2O+□N2↑,再据质量守恒配平其它物质,此反应的化学方程式为10NaN3+2KNO3→K2O+5Na2O+16N2↑。电子转移的方向是从反应物中失电子元素指向得电子元素,数目为失电子总数或得电子总数,则标出电子转移的数目和方向的化学方程式为![]() 。
。


 优百分课时互动系列答案
优百分课时互动系列答案 开心蛙状元作业系列答案
开心蛙状元作业系列答案科目:高中化学 来源: 题型:
【题目】近日某著名白酒生产企业又陷入“塑化剂”事件。据称“塑化剂”大量超标的白酒被人饮用后,可引起肝癌。常见的塑化剂DEHP分子结构如下:关于该塑化剂的说法错误的是 ( )

A. 塑化剂DEHP分子中含有碳、氢和氧三种元素
B. 塑化剂DEHP分子中至少含有两种官能团
C. 塑化剂DEHP分子易溶于酒精
D. 塑化剂DEHP分子可发生取代反应 加成反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是家用消毒液发生器,下列分析错误的是

A.碳棒a是阴极
B.反应中碳棒b附近溶液显酸性
C.电子由碳棒a经溶液流向碳棒b
D.发生器中的总反应:NaCl+H2O![]() NaClO+H2↑
NaClO+H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】0.1mol某有机物的蒸气跟过量O2混合后点燃,生成13.2g CO2和5.4g H2O,该有机物跟金属反应放出H2,又能跟新制Cu(OH)2悬浊液加热时生成红色沉淀,此有机物还能跟乙酸反应生成酯类化合物.该酯类化合物的结构简式可能是( )
A. CH3CH(OCH3) CHOB. OHCCH2CH2COOCH3
C. CH3CH(OOCCH3)CHOD. OHCCH(OH) COOH
查看答案和解析>>
科目:高中化学 来源: 题型:
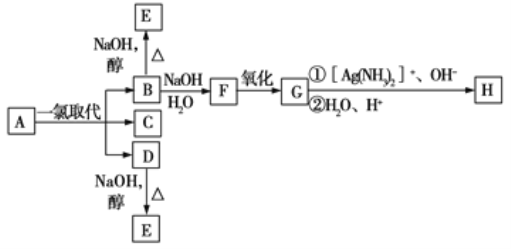
【题目】烷烃A只可能有三种一氯取代产物B、C、D,C的结构简式是![]() ,B和D分别与强碱的醇溶液共热,都只能得到有机化合物E。以上反应及B的进一步反应如图所示:
,B和D分别与强碱的醇溶液共热,都只能得到有机化合物E。以上反应及B的进一步反应如图所示:
已知:R-CHO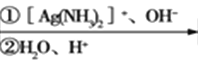 R-COOH
R-COOH
请回答下列问题:
(1)A的结构简式是______。
(2)H的结构简式是______。
(3)B转变为F的反应属于_____反应(填反应类型名称)。
(4)B转变为E的反应属于____反应(填反应类型名称)。
(5)1.16gH与足量的NaHCO3作用,标准状况下可得CO2的体积是____mL。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】农业上有一句俗语“雷雨发庄稼”,该过程中不会涉及到的化学反应是
A.N2+O2 ![]() 2NOB.2NO+O2 → 2NO2
2NOB.2NO+O2 → 2NO2
C.4NH3+5O2![]() 4NO + 6H2OD.3NO2+H2O → 2HNO3+NO
4NO + 6H2OD.3NO2+H2O → 2HNO3+NO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中含有较大量的Cl-、CO32-、OH-,如果只取一次该溶液就能够分别将3种阴离子依次检验出来,正确的操作顺序是
①滴加Mg(NO3)2溶液 ②过滤 ③滴加AgNO3溶液 ④滴加Ba(NO3)2溶液
A.①②④②③B.④②①②③
C.①②③②④D.④②③②①
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以粉煤灰(主要成分:Al2O3、SiO2、少量Fe2O3)为原料,制取Al2O3的部分工艺流程如下:

完成下列填空:
(1)铝原子核外有_____种不同能量的电子,最外层电子的轨道式是_____________,上述流程涉及第二周期元素的原子半径由小到大的顺序是______________________________。
(2) “除铁”是将Fe3+转化为Fe(OH)3沉淀,反应的离子方程式为______________________,检验溶液中Fe3+是否除尽的方法是____________________________________________。
(3)解释“结晶”过程中向AlCl3浓溶液中通入HCl气体的原因。______________________
(4)上述流程可循环的物质是_______________。
(5)工业上将Al2O3溶解在熔化的冰晶石中电解获得铝,该反应的化学方程式为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关叙述正确的是
A.相同温度、相同压强的O2和CO2,两种气体的分子数一定相等
B.相同体积、相同密度的N2和CO,两种气体的分子数一定相等
C.配制450mL 0.1mol·L-1的NaOH溶液,用托盘天平称取NaOH固体1.8g
D.0.45 mol·L-1的NaCl溶液与0.15mol·L-1的AlCl3溶液中含有的Cl-离子数目相等
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com