
(共10分) G 是一种医药中间体,常用来制备抗凝血药,可通过下列路线合成:

(1)A与银氨溶液反应有银镜生成,则A的分子式是________。(1分)
(2)B―→ C的反应类型是________。(1分)
(3)C与E反应生成F的化学方程式________________________________(2分)
(4)F的一种同分异构体能水解且苯环上的一氯代物有一种,任意写出其中一种的结构简式________。(2分)
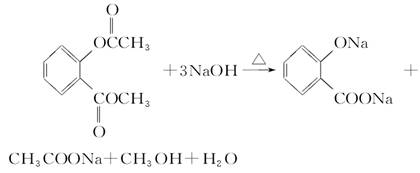
(5)写出F和过量NaOH溶液共热时反应的化学方程式:
__________________________________________________________。(2分)
(6)下列关于G的说法正确的是________。(2分)
a.能与金属钠反应
b.1 mol G最多能和5 mol氢气反应
c.分子式是C9H6O3
d.1molG最多和3molNaOH反应
(1)C2H4O (2)取代反应
(3)
(4) 、
、 、
、 、
、 、
、 、
、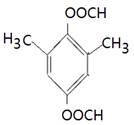 、
、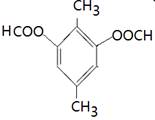 、
、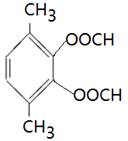 。
。
(任写1个)
(5)
(6)a、c
【解析】(1)A可以发生银镜反应,说明含有羟基,B是乙酸,所以A是乙醛。
(2)根据B和C的结构简式可知羧基中的羟基被氯原子代替,属于取代反应。
(3)根据C和E反应的生成物F的结构简式可判断,E是D和甲醇通过酯化反应生成的,因此E的结构简式为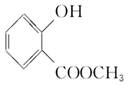 。
。
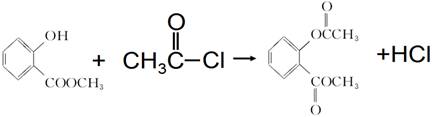
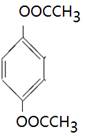
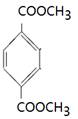
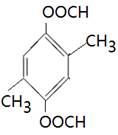
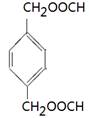
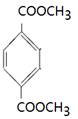
(4)能水解说明含有酯基。苯环上的一氯代物有一种,说明苯环至少含有2个取代基。如果只有2个取代基,则一定是对位的,而且取代基相同,因此取代基可以是-OOCCH3、-CH2OOCH、-COOCH3;如果含有3个取代基,则这3个取代基必须相同,且位于1、3、5位上。由于必须含有酯基,而分子中只有4个氧原子,所以不能成立。若含有4个取代基,则取代基是2个甲基和2个-OOCH。所以同分异构体的结构简式是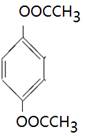 、
、 、
、 、
、 、
、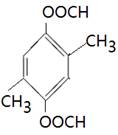 、
、 、
、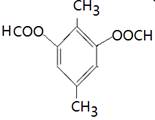 、
、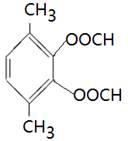 。
。
(5)F中含有2个酯基,水解又生成1个酚羟基,所以需要3mol氢氧化钠。
(6)根据G的结构简式可知,分子式为C9H6O3,C正确。G含有羟基,和钠反应生成氢气,a正确。酯基中的碳氧双键不能和氢气加成,共需要4mol氢气,b不正确。分子含有1个酯基,水解又生成1个酚羟基,所以需要2mol氢氧化钠。


科目:高中化学 来源:2012届三校上海市(复旦、交大、华师大二附中)高三联考化学试卷(带解析) 题型:计算题
(本题共10分)
硫化钠是用于皮革鞣制的重要化学试剂,可用无水芒硝(Na2SO4)与炭粉在高温下反应而制得,反应式如下:Na2SO4+ 4C Na2S+4CO↑ ② Na2SO4+4CO
Na2S+4CO↑ ② Na2SO4+4CO Na2S+4CO2
Na2S+4CO2
(1)现要制取Na2S 7.80 g,若生产过程中无水芒硝(Na2SO4)的利用率为90%,则理论上需要无水芒硝(Na2SO4) g(精确到0.01);
(2)若在反应中生成的Na2S物质的量为1 mol,则消耗的碳单质的物质的量n的范围是
≤ n ≤ ;
(3)若在上述反应中消耗的碳单质为1 mol,生成Na2S的物质的量为y mol,生成的CO和CO2的物质的量之比为x,则y与x的关系式为y= ;
(4)Na2S放置在空气中,会被缓慢氧化成Na2SO3及Na2SO4,现称取已经部分氧化的硫化钠样品39.20 g溶于水中,加入足量盐酸,充分反应后过滤得沉淀9.6 g,放出H2S气体1.12 L(标准状况)。请计算:39.20 g样品中各氧化产物的物质的量(不考虑气体在水中的溶解)。
查看答案和解析>>
科目:高中化学 来源:2010年宁夏银川二中高三上学期第一次月考化学试题 题型:填空题
(共10分)根据下面物质间转换的框图,回答有关问题:
(1)由反应①产生的A、B混合物的工业名称是 。
(2)写出框图中D、E的化学式:D  ;E
;E
(3)如果2mol Na2O2与足量水蒸气反应,可得标准状况下气体的体积是多少 L,同时反应中转移电子总数是  。(NA表示阿佛加德罗常数)
。(NA表示阿佛加德罗常数)
(4)请设计一个简单易行的小实验,证明反应⑤是放热反应。实验方法是
(5)如果A、B混合气体7.8g(平均摩尔质量10g·mol-1),在与G充分反应后,通过足量Na2O2层,可使Na2O2增重 g,并得到O2 m ol。
ol。
查看答案和解析>>
科目:高中化学 来源:2012-2013学年山东省德州市重点中学高二10月月考化学试卷(带解析) 题型:填空题
(每空2分,共10分)
氢氧燃料电池是将H2通入负极,O2通入正极而发生电池反应的,其能量转换率高。
(1)若电解质溶液为KOH溶液,其
正极反应为________________________ _ ___,
负极反应为__________________________________________;
(2)若电解质溶液为H2SO4,其正极反应为________________,负极反应为________ ____;若反应过程中转移了2mol电子,可产生水的质量为_____ ____g。
查看答案和解析>>
科目:高中化学 来源:2011-2012学年三校上海市)高三联考化学试卷(解析版) 题型:计算题
(本题共10分)
硫化钠是用于皮革鞣制的重要化学试剂,可用无水芒硝(Na2SO4)与炭粉在高温下反应而制得,反应式如下: Na2SO4+
4C Na2S+4CO↑ ② Na2SO4+4CO
Na2S+4CO↑ ② Na2SO4+4CO Na2S+4CO2
Na2S+4CO2
(1)现要制取Na2S 7.80 g,若生产过程中无水芒硝(Na2SO4)的利用率为90%,则理论上需要无水芒硝(Na2SO4) g(精确到0.01);
(2)若在反应中生成的Na2S物质的量为1 mol, 则消耗的碳单质的物质的量n的范围是
≤ n ≤ ;
(3)若在上述反应中消耗的碳单质为1 mol,生成Na2S的物质的量为 y mol,生成的CO和CO2的物质的量之比为x,则y与x的关系式为y= ;
(4)Na2S放置在空气中,会被缓慢氧化成Na2SO3及Na2SO4,现称取已经部分氧化的硫化钠样品39.20 g溶于水中,加入足量盐酸,充分反应后过滤得沉淀9.6 g,放出H2S气体1.12 L(标准状况)。请计算:39.20 g样品中各氧化产物的物质的量(不考虑气体在水中的溶解)。
查看答案和解析>>
科目:高中化学 来源:2013届陕西省高二下学期期中考试化学试题(解析版) 题型:填空题
(每空2分共10分)
I.在1L容器中通入CO2、H2各2mol,在一定条件下发生反应:CO2 + H2 CO + H2O,
CO + H2O,
回答下列问题:
(1)在830℃条件下,反应达到平衡时CO2的转化率为50%。若把体系温度降至800℃求得平衡常数K1=0.81,可以推知该反应的正反应为__________反应(填“吸热”、“放热”)。
(2)800℃时,某时刻测得体系中各物质的量如下:n(CO2)=1.2mol,n(H2)=1.5mol,n(CO)=0.9mol,n(H2O)=0.9mol,则此时该反应 进行.(填“向正反应方向”“向逆反应方向”或“处于平衡状态”)。
II.向一容积为1L 的密闭容器中加入一定量的X、Y,发生化学反应X(g)+2Y(s)  2Z(g);△H<0。右图是容器中X、Z的物质的量浓度随时间变化的曲线。
2Z(g);△H<0。右图是容器中X、Z的物质的量浓度随时间变化的曲线。

(1)0~10min 容器内气体的压强逐渐 ___________。(填“变大”、“变小”或“无法确定”)
(2)推测在第7min时曲线变化的原因可能是 ___第13min时曲线变化的原因可能是 __(填序号)
①增加Z的量 ②增加X的量 ③升温 ④降温 ⑤使用催化剂
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com