
����Ŀ����1����֪��TiO2(s)��2Cl2 (g)��2C(s)��TiCl4(l)��2CO(g) ��H����81 kJ��mol��1
2C(s)��O2(g)��2CO(g) ��H����221 kJ��mol��1
д��TiO2��Cl2��Ӧ����TiCl4��O2���Ȼ�ѧ����ʽ��______________________��
��2������Ӧ����㷺�Ľ���������±����������Լ������ĺ������ξ�Ϊ��Ҫ�������¯������ұ��������Ҫ��������������Ҫ��ӦΪ��
Fe2O3(s)+3CO(g) ![]() 2Fe(s)+3CO2(g) ��H = a kJ mol��1
2Fe(s)+3CO2(g) ��H = a kJ mol��1
��֪�� ��Fe2O3(s)+3C(ʯī) = 2Fe(s)+3CO(g) ��H1 = + 489.0 kJ mol��1
��C(ʯī)+CO2(g) = 2CO(g) ��H2 = + 172.5 kJ mol��1
��a =______kJ mol��1��
���𰸡�TiO2(s)��2Cl2(g)��TiCl4(l)��O2(g) ��H����140 kJ��mol��1 -28.5
��������
���ݸ�˹���ɷ������
(1)���ݸ�˹���ɿ�֪������Ӧ��TiO2(s)+2Cl2 (g)+2C(s)=TiCl4(l)+2CO(g)��H=-81kJmol-1�ͷ�Ӧ��2C(s)+O2(g)=2CO(g)��H=-221kJmol-1����ɵ�TiO2��Cl2��Ӧ����TiCl4��O2���Ȼ�ѧ����ʽΪTiO2(s)+2Cl2(g)=TiCl4(l)+O2(g)��H=+140kJmol-1���ʴ�Ϊ��TiO2(s)+2Cl2(g)=TiCl4(l)+O2(g)��H=+140kJmol-1��
(2)��Fe2O3(s)+3C(ʯī)=2Fe(s)+3CO(g) ��H1=+489.0kJmol-1����C(ʯī)+CO2(g)=2CO(g) ��H2=+172.5kJmol-1���ɸ�˹���ɣ�����-����3�õ�Fe2O3(s)+3CO(g)![]() 2Fe(s)+3CO2(g) ��H=(+489.0kJmol-1)-(+172.5kJmol-1)��3=-28.5kJmol-1����a=-28.5���ʴ�Ϊ��-28.5��
2Fe(s)+3CO2(g) ��H=(+489.0kJmol-1)-(+172.5kJmol-1)��3=-28.5kJmol-1����a=-28.5���ʴ�Ϊ��-28.5��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������������ȷ����
A. 2NO2(g)(����ɫ)![]() N2O4(g)(��ɫ)����H<0����ƽ���ƽ����ϵ��ȡ��С�ݻ�������ѹǿ�Ĵ�ʩ����Ϊƽ��������Ӧ�����ƶ�������ϵ��ɫ��dz
N2O4(g)(��ɫ)����H<0����ƽ���ƽ����ϵ��ȡ��С�ݻ�������ѹǿ�Ĵ�ʩ����Ϊƽ��������Ӧ�����ƶ�������ϵ��ɫ��dz
B. H2(g)��I2(g)![]() 2HI(g)����H<0����ƽ���ƽ����ϵ��ȡ�����ݻ�����Сѹǿ�Ĵ�ʩ����Ϊƽ�ⲻ�ƶ�������ϵ��ɫ����
2HI(g)����H<0����ƽ���ƽ����ϵ��ȡ�����ݻ�����Сѹǿ�Ĵ�ʩ����Ϊƽ�ⲻ�ƶ�������ϵ��ɫ����
C. FeCl3��3KSCN![]() Fe(SCN)3(��ɫ)��3KCl����ƽ�������KCl����Ϊƽ�����淴Ӧ�����ƶ�������ϵ��ɫ��dz
Fe(SCN)3(��ɫ)��3KCl����ƽ�������KCl����Ϊƽ�����淴Ӧ�����ƶ�������ϵ��ɫ��dz
D. ����N2��3H2![]() 2NH3��ƽ���ѹǿ���䣬����O2��ƽ������
2NH3��ƽ���ѹǿ���䣬����O2��ƽ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ƻ������һ����ƻ�����Ͷ��γɵľ��нⶾ����֬�����ʵ�����ҩЧ�Ľ���ʳƷ��ƻ����(2���ǻ�������)���������ϵ���Ҫ�������ʣ�ƻ����Ľṹ��ʽΪ![]() ���������˵������ȷ����(����)
���������˵������ȷ����(����)
A. ƻ������һ���������ܷ�����������Ӧ
B. 1 molƻ����������NaHCO3��Һ��Ӧ����2 mol NaHCO3
C. 1 molƻ����������Na��Ӧ����33.6 L H2(��״����)
D. 1 molƻ����ֱ������Na��NaOH��Ӧ�����������ʵ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����¶ȡ��ݻ���ͬ��3���ܱ������У�����ͬ��ʽͶ�뷴Ӧ����ֺ��¡����ݣ���÷�Ӧ�ﵽƽ��ʱ�й���������[��֪N2��g��ʮ3H2��g��![]() 2NH3��g�� ��H=-92.4kJ/mol]������˵����ȷ���ǣ� ��
2NH3��g�� ��H=-92.4kJ/mol]������˵����ȷ���ǣ� ��
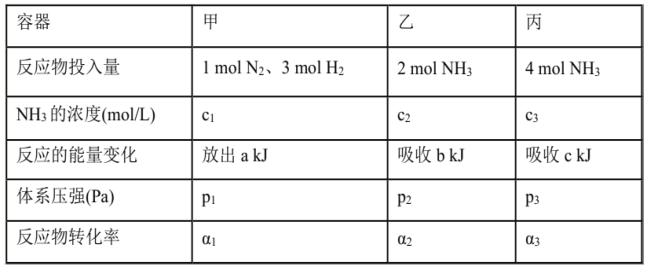
A. 2c1��c3 B. a+b��92.4 C. 2p2��p3 D. ��1+��3��1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ������Fe��FeO��Fe3O4�Ļ�����м���100mL2mol/L�����ᣬǡ��ʹ�������ȫ�ܽ⣬�ų�224mL����״���������壬������Һ�м���KSCN��Һ��Ѫ��ɫ���֡�����������CO�ڸ����»�ԭ��ͬ�����Ĵ˻����ܵõ����������ǣ� ��
A. 11.2gB. 5.6gC. 2.8gD. ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ����汻�������ƣ�Ͷ������ˮ�г�ַ�Ӧ���ų�3.36L����״���������壬�������ڵ���¸պ���ȫ��Ӧ����÷�Ӧ����Һ�����Ϊ200mL������Һ��100mL6mol/L������ǡ����ȫ�к͡��Լ��㣨��Ҫд��������̣���
��1����Ӧ����NaOH��Һ�����ʵ���Ũ���Ƕ���______��
��2���ñ��汻�������Ƹ��ɷֵ������Ƕ���g______��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������¶ȣ��������ݲ�һ���������
A.��ѧ��Ӧ����vB.ˮ�����ӻ�����KW
C.��ѧƽ�ⳣ��KD.�����Ƶ�ˮ��ƽ�ⳣ��Kb
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���к��ȵIJⶨ�Ǹ�����Ҫ�Ķ���ʵ�顣ȡ0.55mol/L��NaOH��Һ50mL��0.25mol/L������50mL����ͼ��ʾ��װ���н����к��ȵIJⶨʵ�飬�ش��������⣺

��1������ͼʵ��װ�ÿ���������ȱ�ٵ�һ�ֲ�����Ʒ��__________________________��
��2��������60mL 0.25mol��L-1H2SO4��50mL 0.55mol��L-1NaOH��Һ���з�Ӧ������ʵ����ȣ����ų�������___________�����ȡ���������ȡ�������ʵ���������ȷ���������к���__________���ȡ�������ȡ�����
��3������NaOH��Һ����ȷ�����ǣ�________�� (������ѡ��)��
A���ز������������롡 B���������������� C��һ��Ѹ�ٵ���
��4��ʹ������NaOH��Һ��Ͼ��ȵ���ȷ�����ǣ�________�� (������ѡ��)��
A�����¶ȼ�С�Ľ��� B���ҿ�ӲֽƬ�ò���������
C����������ձ� D���������¶ȼ��ϵĻ��β������������ؽ���
��5��ʵ���������±���������д�±��еĿհף�
�¶� ʵ������� | ��ʼ�¶�t1�� | ��ֹ�¶�t2/�� | �¶Ȳ�ƽ��ֵ (t2��t1)/�� | ||
H2SO4 | NaOH | ƽ��ֵ | |||
1 | 26.2 | 26.0 | 26.1 | 29.5 | ______ |
2 | 27.0 | 27.4 | 27.2 | 32.3 | |
3 | 25.9 | 25.9 | 25.9 | 29.2 | |
4 | 26.4 | 26.2 | 26.3 | 29.8 | |
�ڽ�����Ϊ0.55 mol/L NaOH��Һ��0.25 mol/L������Һ���ܶȶ���1 g/cm3���кͺ�������Һ�ı�����c��4.18 J/(g����)�����к�����H��___________ ( ȡС�����һλ)��
������ʵ����ֵ�����57.3 kJ/mol��ƫ�����ƫ���ԭ�������(����ĸ)_________��
a��ʵ��װ�ñ��¡�����Ч����
b�����¶ȼƲⶨNaOH��Һ��ʼ�¶Ⱥ�ֱ�ӲⶨH2SO4��Һ���¶�
c���ֶ�ΰ�NaOH��Һ����ʢ�������С�ձ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������ͼʾ���ó��Ľ��۲���ȷ����

A. ͼ����CO(g)+H2O(g)![]() CO2(g)+H2(g)��ƽ�ⳣ���뷴Ӧ�¶ȵĹ�ϵ������˵���÷�Ӧ����H<0
CO2(g)+H2(g)��ƽ�ⳣ���뷴Ӧ�¶ȵĹ�ϵ������˵���÷�Ӧ����H<0
B. ͼ����������H2O2���ֽ�ų������ķ�Ӧ��c(H2O2 )�淴Ӧʱ��仯��������˵�����ŷ�Ӧ�Ľ���H2O2�ֽ�������С
C. ͼ������������0.1000 mol��L1NaOH��Һ�ζ�20.00 mL 0.1000 mol��L1ijһԪ��HX�ĵζ�������˵��HX��һԪǿ��
D. ͼ������������Na2SO4��ȥ��Һ��Ba2+�ﵽ�����ܽ�ƽ��ʱ����Һ��c(Ba2+ )��c(SO42)�Ĺ�ϵ������˵����Һ��c(SO42 )Խ��c(Ba2+ )ԽС
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com