
利用 Y 型管与其它仪器组合可以进行许多实验(固定装置略)。分析并回答下列问题:
(1)实验目的:验证SO2的氧化性。将胶头滴管中浓硫酸分别滴入 Y型管的两个支管中,所产生的两种气体相遇发生反应:SO2+2H2S=3S+2H2O,则在支管交叉处实验现象为 ,硫化亚铁处加水的目的是 。
(2)实验目的:探究 SO2与BaCl2反应生成沉淀的条件。SO2通入BaCl2溶液并不产生沉淀,再通入另一种气体后就产生了白色沉淀。常温下,若由右侧 Y型管产生另一种气体,则在其左右支管应放置的药品是 和 ,导气管A的作用是 。
(3)实验目的:铁镁合金中铁含量的测定。①读取量气管中数据时,若发现水准管中的液面高于量气管中液面,应采取的措施是 ;②若称得铁镁合金的质量为 0.080g,量气管中初读数为1.00mL,末读数为 45.80mL(已折算为标准状况),则合金中铁的百分含量为 (精确到0.01%)。
(17分)
(1)(共4分)管壁内有淡黄色固体生成(2分) 稀释浓硫酸,防止硫化氢被氧化(2分)
(2)(共6分)浓氨水、生石灰(或碱石灰、固体NaOH,4分) 保持集气瓶内外气压平衡(1分),以便左右两边产生的气体顺利导入(1分)
(3)(共7分)①放低(或移动)水准管位置(2分 ),使水准管、量气管内液面相平(2分) ②70.00%(3分)
解析试题分析:(1)依题意,二氧化硫气体与硫化氢气体反应生成单质硫和水,由此推断反应现象为管壁内有淡黄色固体生成、有液滴生成;由于硫化氢能被浓硫酸氧化,则硫化亚铁出加水的目的是稀释浓硫酸,防止稀硫酸与硫化亚铁反应放出的硫化氢气体被浓硫酸氧化;(2)根据二氧化硫的性质推断,右侧Y型管的作用是制取氨气,由于无加热仪器,则选择的试剂为浓氨水液体和生石灰或碱石灰或氢氧化钠固体,产生的氨气溶于BaCl2溶液,得到碱性溶液,再通入二氧化硫气体时,二氧化硫与氨水反应生成亚硫酸铵,亚硫酸铵与BaCl2溶液发生复分解反应,可以得到白色BaSO3沉淀和NH4Cl溶液;导管A的作用是保持集气瓶内外气压平衡,以便左右两边产生的气体顺利导入;(3)读数时,应放低(或移动)水准管位置,使水准管中的液面高于量气管中液面相平,以免造成误差;防止倒吸;设铁镁合金含有xmolFe、ymolMg,根据m=n?M,则①56x+24y=0.080;由于Fe+2HCl=FeCl2+H2↑、Mg+2HCl=MgCl2+H2↑中的系数之比等于物质的量之比,充分反应后得到氢气的物质的量为(x+y)mol;由于初末读数相差(45.80—1.00)mL=(45.80—1.00)×10—3L,说明充分反应后得到氢气的体积为(45.80—1.00)×10—3L;由于n=V/Vm,根据氢气的物质的量相等可得:②x+y =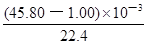 ;解①②可得:x=0.001,y=0.001,则合金中铁的质量为0.056g,镁为0.024g,所以合金中铁的质量分数为
;解①②可得:x=0.001,y=0.001,则合金中铁的质量为0.056g,镁为0.024g,所以合金中铁的质量分数为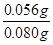 ×100%=70%。
×100%=70%。
考点:考查综合实验和化学计算,涉及实验现象的描述、解释原因、制取氨气的试剂、解释目的、量气方法、物质的量在化学方程式计算中的应用、摩尔质量、气体摩尔体积、质量分数等。


科目:高中化学 来源: 题型:实验题
氧化二氯是棕黄色刺激性气体,熔点:﹣116℃,沸点3.8℃.氧化二氯不稳定,接触一般有机物易爆炸;它易溶于水(1:100),同时反应生成次氯酸溶液;制备出之后要冷却成固态以便操作和贮存.制备少量Cl2O,是用干燥的氯气和HgO反应(还生成HgO?HgCl2).装置示意如图(铁架台和夹持仪器已略去).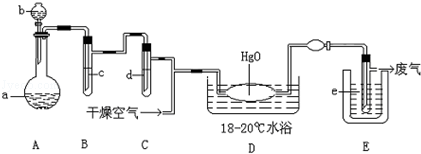
(1)A中盛有的深色固体试剂a是 ,分液漏斗中试剂b是
(2)B中盛有液体c是 ,C中的液体d是
(3)D中所发生反应的化学方程式是
(4)E中的保温瓶中盛有致冷剂,它应是 (在干冰、冰水、液态空气中选择),在E的内管得到的氧化二氯中可能含有杂质是
(5)装置A、B、C间的连接方式与D、E间的连接方式有明显的区别,这区别是 ,用这些不同的连接方式的主要理由是 .
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
高纯度单晶硅是典型的无机非金属材料,是制备半导体的重要材料,它的发现和使用曾引起计算机的一场“革命”。高纯硅通常用以下方法制备:用碳在高温下还原二氧化硅制得粗硅(含Fe、Al、B、P等杂质),粗硅与氯气反应生成四氯化硅(反应温度为450~500℃),四氯化硅经提纯后用氢气还原可得高纯硅。以下是实验室制备四氯化硅的装置图。
相关信息:a.四氯化硅遇水极易水解;b.硼、铝、铁、磷在高温下均能与氯气直接化合生成相应的氯化物;c.有关物质的物理常数见下表:
| 物质 | SiCl4 | BCl3 | AlCl3 | FeCl3 | PCl5 |
| 沸点/℃ | 57.7 | 12.8 | — | 315 | — |
| 熔点/℃ | -70.0 | -107.2 | — | — | — |
| 升华温度/℃ | — | — | 180 | 300 | 162 |
| 方案 | 不足之处 |
| 甲 | |
| 乙 | |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
氧化亚铜是大型水面舰船防护涂层的重要原料。某小组进行如下研究,请填写下列空白。
实验1:氧化亚铜的制取氧化亚铜可用葡萄糖和新制氢氧化铜悬浊液反应制取。文献表明,条件控制不当时会有少量CuO生成。
(1)实验室制取氢氧化铜悬浊液的离子方程式为____________。
(2)实验室用此方法制取并获得少量氧化亚铜固体,需要的玻璃仪器有试管、酒精灯、烧杯____________和____________。
(3)若要探究该反应发生的最低温度,应选用的加热方式为____________。
实验2:测定氧化亚铜的纯度
方案1:称取实验1所得固体m g,采用如下装置进行实验。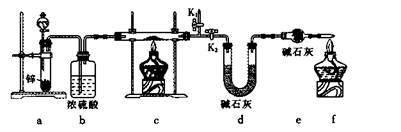
(4)装置a中所加的酸是____________(填化学式)。
(5)通过测出下列物理量,能达到实验目的的是____________。
| A.反应前后装置a的质量 |
| B.装置c充分反应后所得固体的质量 |
| C.反应前后装置d的质量 |
| D.反应前后装置e的质量 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
某化学兴趣小组同学展开对漂白剂亚氯酸钠(NaClO2)的研究。
实验Ⅰ:制取NaClO2晶体
已知:NaClO2饱和溶液在温度低于38℃时析出晶体是NaClO2?3H2O,高于38℃时析出晶体是NaClO2,高于60℃时NaClO2分解成NaClO3和NaCl。利用下图所示装置进行实验。
(1)装置③的作用是 。
(2)装置②中产生ClO2的化学方程式为 ;装置④中制备NaClO2的化学方程式为 。
(3)从装置④反应后的溶液获得NaClO2晶体的操作步骤为:
①减压,55℃蒸发结晶;②趁热过滤;③ ;④低于60℃干燥,得到成品。
实验Ⅱ:测定某亚氯酸钠样品的纯度。
设计如下实验方案,并进行实验:
①准确称取所得亚氯酸钠样品m g于烧杯中,加入适量蒸馏水和过量的碘化钾晶体,再滴入适量的稀硫酸,充分反应(已知:ClO2-+ 4I-+4H+ =2H2O+2I2+Cl-)。将所得混合液配成250mL待测溶液。
②移取25.00mL待测溶液于锥形瓶中,加几滴淀粉溶液,用c mol?L-1 Na2S2O3标准液滴定,至滴定终点。重复2次,测得平均值为V mL(已知:I2 +2S2O32-=2I-+S4O62-)。
(4)达到滴定终点时的现象为 。
(5)该样品中NaClO2的质量分数为 (用含m、c、V的代数式表示)。
(6)在滴定操作正确无误的情况下,此实验测得结果偏高,原因用离子方程式表示为
。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
氮化铝(AIN)是一种新型无机材料,广泛应用于集成电路生产领域。某化学研究小组利用氮气、氧化铝和活性炭制取氮化铝,设计下图实验装置。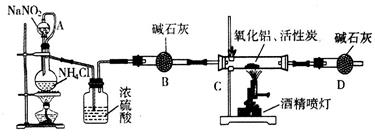
试回答:
(1)实验中用饱和NaNO2与 NH4C溶液制取氮气的化学方程式为 。
(2)装置中分液漏斗与蒸馏烧瓶之间的导管A的作用是 (填写序号)。
a.防止NaNO2饱和溶液蒸发 b.保证实验装置不漏气 c.使NaNO2饱和溶液容易滴下
(3)按图连接好实验装置,检查装置气密性的方法是 。
(4)化学研究小组的装置存在严重问题,请说明改进的办法 。
(5)反应结束后,某同学用下图装置进行实验来测定氮化铝样品的质量分数(实验中导管体积忽略不计)。已知:氮化铝和NaOH溶液反应生成Na[Al(OH)4]和氨气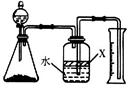 。
。
①广口瓶中的试剂X最好选用 (填写序号)。
a.汽油 b.酒精 c.植物油 d.CCl4
②广口瓶中的液体没有装满(上方留有空间),则实验测得NH3的体积将 (填“偏大”、“偏小”、“不变”)。
③若实验中称取氮化铝样品的质量为10.0g,测得氨气的体积为3.36L(标准状况),则样品中AlN的质量分数为 。
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列实验装置或操作正确的是 ( )

| A.实验① 制取氨气 |
| B.实验② 溴水褪色证明了乙烯可以与溴发生加成反应 |
| C.实验③ 比较红磷和白磷的着火点 |
| D.实验④ 用CaC2和饱和食盐水反应制取C2H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
可用如图所示装置制取、净化、收集的气体是
| A.锌和稀硝酸反应制一氧化氮 |
| B.亚硫酸钠与浓硫酸反应制二氧化硫 |
| C.铁和稀硫酸反应制氢气 |
| D.浓氨水和生石灰反应制取氨气 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列有关操作或说法不正确的是( )
| A.“中和滴定”实验中,容量瓶和锥形瓶用蒸馏水洗净后即可使用,滴定管和移液管用蒸馏水洗净后,必须干燥或润洗后方可使用 |
| B.除去干燥CO2中混有的少量SO2,可将混合气体依次通过盛有酸性KMnO4溶液、浓硫酸的洗气瓶 |
| C.在硫酸镁溶液中加入氢氧化钠可以得到氢氧化镁沉淀 |
| D.将Mg(OH)2沉淀转入蒸发皿中,加足量稀盐酸,加热蒸干得无水MgCl2固体 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com