
氧化二氯是棕黄色刺激性气体,熔点:﹣116℃,沸点3.8℃.氧化二氯不稳定,接触一般有机物易爆炸;它易溶于水(1:100),同时反应生成次氯酸溶液;制备出之后要冷却成固态以便操作和贮存.制备少量Cl2O,是用干燥的氯气和HgO反应(还生成HgO?HgCl2).装置示意如图(铁架台和夹持仪器已略去).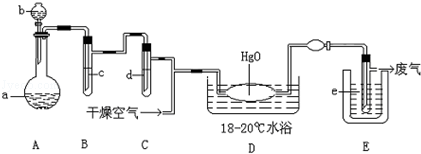
(1)A中盛有的深色固体试剂a是 ,分液漏斗中试剂b是
(2)B中盛有液体c是 ,C中的液体d是
(3)D中所发生反应的化学方程式是
(4)E中的保温瓶中盛有致冷剂,它应是 (在干冰、冰水、液态空气中选择),在E的内管得到的氧化二氯中可能含有杂质是
(5)装置A、B、C间的连接方式与D、E间的连接方式有明显的区别,这区别是 ,用这些不同的连接方式的主要理由是 .
(1)高锰酸钾;浓盐酸.(2)饱和食盐水;浓硫酸.(3)2HgO+2Cl2=Cl2O+HgO?HgCl2.
(4)液态空气;液氯.(5)A、B、C间用乳胶管连接,D、E间不能乳胶管连接;Cl2O遇有机物易爆炸.
解析试题分析:(1)由装置图可知,A中发生反应制备氯气,反应不需加热,深色固体试剂a与溶液b反应,通常应为高锰酸钾与浓盐酸,故a为高锰酸钾,b为浓盐酸.故答案为:高锰酸钾;浓盐酸.(2)HCl易挥发,A中生成的氯气中含有HCl、H2O,用饱和食盐水吸收HCl,用浓硫酸干燥,先除氯化氢,后干燥.故B中盛有液体c是试剂饱和食盐水,C中的液体d是浓硫酸.故答案为:饱和食盐水;浓硫酸.(3)由信息可知,D中氯气与HgO反应生成Cl2O与HgO?HgCl2.反应方程式为2HgO+2Cl2=Cl2O+HgO?HgCl2.故答案为:2HgO+2Cl2=Cl2O+HgO?HgCl2.(4)由题目信息可知,氧化二氯气体的熔点﹣116℃,熔点很低.所以选择沸点很低的液态空气进行制冷.根据工艺流程可知,D中反应氯气可能不能成分反应,由于氯气易液化,所以E的内管得到的氧化二氯中可能含有杂质是液氯.故答案为:液态空气;液氯.(5)由信息可知,氧化二氯不稳定,接触一般有机物易爆炸,因此 Cl2O不能与有机物接触,所以A、B、C间用乳胶管连接,D、E间不能乳胶管连接.故答案为:A、B、C间用乳胶管连接,D、E间不能乳胶管连接;Cl2O遇有机物易爆炸.
考点:制备实验方案的设计.


 浙大优学小学年级衔接捷径浙江大学出版社系列答案
浙大优学小学年级衔接捷径浙江大学出版社系列答案科目:高中化学 来源: 题型:实验题
三氯化六氨合钴(Ⅲ)是一种重要的化工产品, 实验中采用H2O2作氧化剂,在大量氨和氯化铵存在下,选择活性炭作为催化剂将Co(Ⅱ)氧化为Co(Ⅲ),来制备三氯化六氨合钴(Ⅲ)配合物,反应式为:2CoCl2·6H2O + 10NH3 + 2NH4Cl + H2O2 活性炭2[Co(NH3)6]Cl3 +14H2O
已知:① 钴(Ⅱ)与氯化铵和氨水作用,经氧化后一般可生成三种产物:紫红色的二氯化一氯五氨合钴[Co(NH3)5 Cl]Cl2晶体、砖红色的三氯化五氨一水合钴[Co(NH3)5 H2O]Cl3晶体、橙黄色的三氯化六氨合钴[Co(NH3)6]Cl3晶体,控制不同的条件可得不同的产物(如温度不同产物也不同)。293K时,[Co(NH3)6]Cl3在水中的溶解度为0.26mol/L
②CoCl2、[Co(NH3)6]Cl3、[Co(NH3)5 Cl]Cl2在水中能完全电离
③制备三氯化六氨合钴(Ⅲ)粗产品的流程如下:
④三氯化六氨合钴(Ⅲ)粗产品的提纯流程如下:
⑤制备过程中可能用到的部分装置如下:
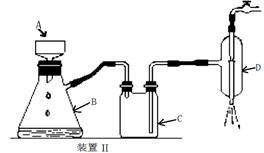

请回答下列问题:
(1)操作B的名称是 ,操作A后所弃去的沉淀中一定有 。
(2)CoCl2在没有铵盐存在的情况下,遇氨水生成蓝色沉淀,该反应的离子方程式为 。原料NH4Cl的主要作用有:① ;②提供NH3。
(3)冷却至10℃后,步骤B中逐滴加入H2O2溶液的目的:① ;②使反应温和进行。
(4)操作A的名称为 ,进行该操作的装置是 (填序号)。
A.装置Ⅰ B.装置Ⅱ C.装置Ⅲ
若操作过程中,发现漏斗尖嘴处有少量晶体析出,处理方法是 。
装置Ⅱ中仪器A、B、C、D的名称分别是 、 、 、 。
(5)步骤C进行洗涤时要用到两种试剂,应该先用_____(填序号,下同)洗涤,后用 洗涤。
A. 饱和氯化钠溶液 B. 无水乙醇 C. 浓盐酸
(6)你认为本实验提高产率的关键步骤有哪些? 。
(7)与[Co(NH3)6]Cl3类似的产品还有[Co(NH3)5Cl]Cl2,请简述验证某晶体是[Co(NH3)6]Cl3还是
[Co(NH3)5Cl]Cl2的实验方案: 。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
醇脱水是合成烯烃的常用方法,实验室合成环己烯的反应和实验装置如下: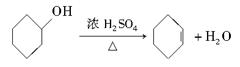
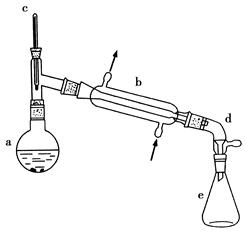
可能用到的有关数据如下:
| | 相对分子质量 | 密度 g/cm3 | 沸点/℃ | 溶解性 |
| 环己醇 | 100 | 0.9618 | 161 | 微溶于水 |
| 环己烯 | 82 | 0.8102 | 83 | 难溶于水 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
碳铵是一种较常使用的化肥,它在常温下易分解。某化学兴趣小组对碳铵的成分存在疑问,进行了如下探究。
【定性实验】检验溶液中的阴、阳离子。
取少量固体放入试管中,加入盐酸,把生成的气体通入澄清石灰水中,有白色沉淀生成。再另取少量碳铵放入试管中,加入浓NaOH溶液,加热,用湿润的红色石蕊试纸检验生成的气体,石蕊试纸变蓝色。
(1)根据实验现象,推测碳铵中所含有阴离子可能是 和 。
(2)据实验现象,碳铵与足量NaOH溶液加热反应的离子方程式可能是 。
【定量实验】测定碳铵中C元素和N元素质量比。
该兴趣小组准确称取ag碳铵,加热使之分解,并把产物通入碱石灰中,如下图所示。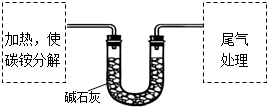
(1)碳铵固体应放在 中进行加热。
| A.试管 | B.蒸发皿 | C.烧瓶 | D.坩埚 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
胆矾(CuSO4·5H2O)是铜的重要化合物,有着广泛的应用。以下是CuSO4·5H2O的实验室制备流程图。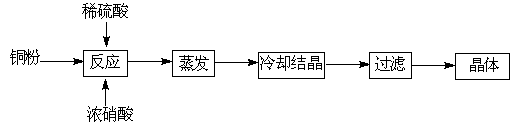
完成下列各题:
Ⅰ.(1)向含铜粉的稀硫酸中滴加浓硝酸,随着铜粉的溶解可能观察到的实验现象 、 。
(2)制得的胆矾晶体(CuSO4·5H2O)中可能存在的杂质是 (写化学式)。
(3)采用重量法测定CuSO4·5H2O的含量时,步骤如下:
①取样,称量 ②加水溶解 ③加氯化钡溶液生成沉淀 ④过滤(其余步骤省略)
在过滤前,需要检验是否沉淀完全,其操作是 。
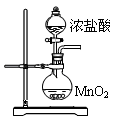
Ⅱ. 某研究性学习小组用ZRY-1型热重分析仪对12.5克硫酸铜晶体(CuSO4·5H2O)进行热重分析,随温度的升高,硫酸铜晶体依次发生下列反应。
a.CuSO4·5H2O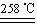 CuSO4+5H2O
CuSO4+5H2O
b.CuSO4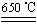 CuO+SO3↑,2SO3
CuO+SO3↑,2SO3 2SO2+O2
2SO2+O2
c.4CuO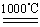 2Cu 2 O+O2↑
2Cu 2 O+O2↑
请回答下列问题:
(1)实验过程中热重分析仪测得残留固体质量为3.8 g,试推断该固体的组分是 (写化学式),其对应的物质的量之比是 。
(2)热重分析仪加热晶体至恒重后,将全部气体导出,通入氢氧化钡溶液充分反应,所得沉淀经过滤、洗涤、干燥,质量为 g。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
(13分)某化学兴趣小组的同学用下图所示实验装置进行实验研究(图中a、b、c表示止水夹),请对其方案进行完善或评价。
(1)实验室将B、C、E相连后,以浓盐酸和 为原料可制取Cl2。
(2)利用实验室常用方法制取氯气,将A、C、E相连,在丙中加入适量水,即可制得氯水.将所得氯水分为两份,进行Ⅰ、Ⅱ两个实验,实验操作如下,将现象①填入下表:
| 实验 序号 | 实验操作 | 现象 |
| Ⅰ | 将氯水滴入品红溶液 | ① |
| Ⅱ | 氯水中加入碳酸氢钠粉末 | 有无色气泡产生 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
三氯化磷(PCl3)是一种重要的有机合成催化剂。实验室常用红磷与干燥的Cl2制取PCl3,装置如下图所示。
已知:红磷与少量Cl2反应生成PCl3,与过量Cl2反应生成PCl5。PCl3遇O2会生成POCl3(三氯氧磷), POCl3溶于PCl3,PCl3遇水会强烈水解生成H3PO3和HCl。PCl3、POCl3的熔沸点见下表。
| 物质 | 熔点/℃ | 沸点/℃ |
| PCl3 | -112 | 75.5 |
| POCl3 | 2 | 105.3 |
| 实验步骤 | 实验现象 | 实验结论 |
| ① | | 溶液X中含有Na+ |
| ② | | 溶液X中含有Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
利用 Y 型管与其它仪器组合可以进行许多实验(固定装置略)。分析并回答下列问题:
(1)实验目的:验证SO2的氧化性。将胶头滴管中浓硫酸分别滴入 Y型管的两个支管中,所产生的两种气体相遇发生反应:SO2+2H2S=3S+2H2O,则在支管交叉处实验现象为 ,硫化亚铁处加水的目的是 。
(2)实验目的:探究 SO2与BaCl2反应生成沉淀的条件。SO2通入BaCl2溶液并不产生沉淀,再通入另一种气体后就产生了白色沉淀。常温下,若由右侧 Y型管产生另一种气体,则在其左右支管应放置的药品是 和 ,导气管A的作用是 。
(3)实验目的:铁镁合金中铁含量的测定。①读取量气管中数据时,若发现水准管中的液面高于量气管中液面,应采取的措施是 ;②若称得铁镁合金的质量为 0.080g,量气管中初读数为1.00mL,末读数为 45.80mL(已折算为标准状况),则合金中铁的百分含量为 (精确到0.01%)。
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列实验操作正确且能达到预期目的的是( )
| | 实验目的 | 操作 |
| ① | 比较水和乙醇中羟基氢的活泼性强弱 | 用金属钠分别与水和乙醇反应 |
| ② | 欲证明CH2=CHCHO中含有碳碳双键 | 滴入KMnO4酸性溶液,看紫红色是否褪去 |
| ③ | 欲除去苯中混有的苯酚 | 向混合液中加入浓溴水,充分反应后,过滤 |
| ④ | 证明SO2具有漂白性 | 将SO2通入酸性KMnO4溶液中 |
| ⑤ | 比较确定铜和镁的金属活动性强弱 | 用石墨作电极电解Mg(NO3)2、Cu(NO3)2的混合液 |
| ⑥ | 确定碳和硅两元素非金属性强弱 | 测同温同浓度Na2CO3和Na2SiO3水溶液的pH |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com