
【题目】A、B、C、D、E均为有机物,其中A是化学实验中最常见的有机物,它易溶于水并有特殊香味;B的产量可衡量一个国家石油化工发展的水平,有关物质的转化关系如图①所示:
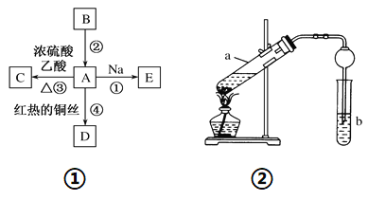
(1)写出B的结构简式________;A中能体现该物质性质的原子团的名称为______。
(2)写出下列反应的化学方程式:反应①________________;反应④________________。
(3)实验室利用反应③制取C,常用图②装置:
①a试管中的主要化学反应的方程式为_________________,反应类型是______。
②在实验中球形干燥管除起冷凝作用外,另一个重要作用是________________。
③试管b中观察到的现象是______________________。
【答案】 CH2=CH2 羟基 2CH3CH2OH+2Na→2CH3CH2ONa+H2↑ 2CH3CH2OH+O2![]() 2CH3CHO+2H2O CH3COOH+CH3CH2OH
2CH3CHO+2H2O CH3COOH+CH3CH2OH![]() CH3COOCH2CH3+H2O 酯化反应(或取代反应) 防倒吸 液体分层
CH3COOCH2CH3+H2O 酯化反应(或取代反应) 防倒吸 液体分层
【解析】B的产量可衡量一个国家石油化工发展的水平,则B是乙烯。A是化学实验室中常见的有机物,它易溶于水并有特殊香味,根据框图中信息,A能与Na、乙酸反应,在红热铜丝发生催化氧化,可推知A是乙醇。根据框图中的转化关系、反应条件和反应试剂可推得,C是乙酸乙酯,D是乙醛,E是乙醇钠,据此解答。
解析:(1)B是乙烯,结构简式为CH2=CH2,A是乙醇,能体现该物质性质的官能团是羟基。
(2)反应①是乙醇与钠反应生成乙醇钠与氢气,反应方程式为2CH3CH2OH+2Na→2CH3CH2ONa+H2↑;反应④是乙醇的催化氧化,方程式为2CH3CH2OH+O2![]() 2CH3CHO+2H2O。
2CH3CHO+2H2O。
(3)①a试管中的主要化学反应是乙酸与乙醇发生酯化反应生成乙酸乙酯,化学方程式为CH3COOH+CH3CH2OH![]() CH3COOCH2CH3+H2O。
CH3COOCH2CH3+H2O。
②由于乙酸与乙醇均极易溶于水,则在实验中球形干燥管除起冷凝作用外,另一个重要作用是防止液体倒吸。
③由于乙酸乙酯不溶于水,则试管b中观察到的现象是液体分层。


科目:高中化学 来源: 题型:
【题目】已知N≡N键能为946 KJ/mol,H—N键能为391KJ/mol,根据化学方程式:N2 + 3H2 ![]() 2NH3 ΔH=-92 KJ/mol,则H—H键的键能是
2NH3 ΔH=-92 KJ/mol,则H—H键的键能是
A. < 436 KJ/mol B. 436 KJ/mol C. 497 KJ/mol D. 467 KJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某红色固体粉末样品可能含有Fe2O3和Cu2O中的一种或两种,某校化学自主探究实验小组拟对其组成进行探究。
查阅资料:Cu2O在酸性溶液中会发生反应:Cu2O+2H+=Cu+Cu2++H2O
探究一:用如图所示装置进行实验,回答下列问题:
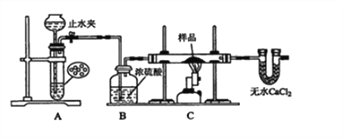
(1)仪器组装完成后,夹好止水夹,______________________ ,则说明装置A的气密性良好。
(2)装置A是氢气的发生装置,可以选用的药品是______(填选项)
A.稀硫酸和锌片 B.稀硝酸和铁片
C.氢氧化钠溶液和铝片 D.浓硫酸和镁片
(3)从下列实验步骤中,选择正确的操作顺序:①____________③(填序号)。
①打开止水夹
②熄灭C处的酒精喷灯
③C处冷却至室温后,关闭止水夹
④点燃C处的酒精喷灯
⑤收集氢气并验纯
⑥通入气体一段时间,排尽装置内的空气
探究二:
(4)甲同学取少量样品于试管中,加入适量的稀硫酸,若无红色物质生成,则说明样品中不含Cu2O;乙同学认为观点不正确,其原因是_____________(用离子方程式表示);丙同学另取少量样品于试管中,加入适量的浓硝酸,产生红棕色的气体.证明样品中一定含有________,其反应的离子方程式为_____;丁同学设计实验证明另一种物质是否存在,则其设计方案中检验另一种物质所有试剂名称为______________。
(5)取一定量样品于烧杯中,加入足量的稀硫酸,若反应后经过滤得到固体3.2g,滤液中Fe2+有1.0mol,则样品中n(Cu2O)=_________mol.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外活动小组用如图装置进行实验,试回答下列问题: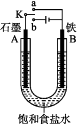
(1)若开始时开关K与a连接,则B极的电极反应为。
(2)若开始时开关K与b连接,则B极的电极反应为 , 总反应的离子方程式为。
(3)有关上述实验,下列说法正确的是。
A.溶液中Na+向A极移动
B.从A极处逸出的气体能使湿润的KI淀粉试纸变蓝
C.反应一段时间后加适量盐酸可恢复到电解前电解质的浓度
D.若标准状况下B极产生2.24 L气体,则溶液中转移0.2 mol电子
(4)该小组同学认为,如果模拟工业上离子交换膜法制烧碱的方法,那么可以设想用如图装置电解硫酸钾溶液来制取氢气、氧气、硫酸和氢氧化钾。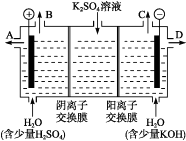
①该电解槽的阳极反应为。 此时通过阴离子交换膜的离子数(填“大于”“小于”或“等于”)通过阳离子交换膜的离子数。
②制得的氢氧化钾溶液从出口(填“A”、“B”、“C”或 “D”)导出。
③电解过程中阴极区碱性明显增强,用平衡移动原理解释原因
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(Ⅰ)已知有机物:
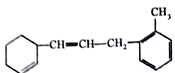
(1)该物质苯环上的一氯代物有_____种。
(2)1mol该物质和溴水混合,消耗Br2的物质的量为_____mol。
(3)1mol该物质和H2发生加成反应最多消耗H2______mol。
(4)下列说法不正确的是________(填序号)。
A.此物质可发生加聚、加成、取代、氧化等反应
B.1mol该物质中有2mol苯环
C.使溴水褪色的原理与乙烯相同
D.能使酸性KMnO4溶液褪色,发生的是加成反应
(Ⅱ)某有机物A化学式为CxHyOz,15gA完全燃烧可生成22gCO2和9gH2O。试求:
(5)该有机物的最简式________________。
(6)若A的相对分子质量为60且和Na2CO3混合有气体放出,A和醇能发生酯化反应,则A的结构简式为___________。
(7)若A的相对分子质量为60且是易挥发有水果香味的液体,能发生水解反应,则其结构简式为____________。
(8)若A分子结构中含有6个碳原子,具有多元醇和醛的性质,是人体生命活动的一种重要物质。则其结构简式为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)X、Y两种主族元素能形成XY2型化合物,已知XY2中共有38个电子,若XY2为常见元素形成的离子化合物,其电子式为______;若XY2为共价化合物时,其结构式为_____。
(2)现有a~g7种短周期元素,它们在周期表中的位置如下,请据此回答下列问题:
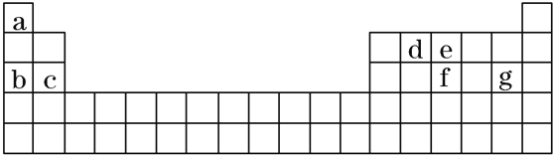
①元素的原子间反应最容易形成离子键的是_____(填序号,下同),容易形成共价键的是___。
A.c和f B.b和g C.d和g D.b和e
②写出a~g7种元素形成的所有原子都满足最外层为8电子结构的任意一种分子的分子式___。
(3)将2moH2O和2molCO置于1L容器中,在一定条件下加热至高温,发生如下可逆反应:2H2O(g)![]() 2H2(g)+O2(g)、2CO(g)+O2(g)
2H2(g)+O2(g)、2CO(g)+O2(g)![]() 2CO2(g)。
2CO2(g)。
①当上述系统达到平衡时,欲求其混合气体的平衡组成。则至少还需婴知道两种气体的平衡浓度,但这两种气体不能同时是______或______。
②若平衡时O2和CO2的物质的量分别为n(O2)甲=amol,n(CO2)甲=bmol。试求n(H2O)甲=_____(用含a、b的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在某温度时将a mol/L 氨水滴入10mL1.0mol/L盐酸中,溶液pH和温度随加入氨水体积变化曲线如图所示。下列有关说法正确的是

A. a<1.0 B. 水的电离程度:b<d<c
C. C点:c(NH4+)=1.0mol/L D. d点:c(Cl-)<c(NH4+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】稀土有工业“黄金”之称,我国稀土资源丰富。目前从氟碳铈矿(主要化学成分为CeFCO3)提取铈族稀土元素的冶炼处理工艺已经发展到十几种,其中一种提取铈的工艺流程如下:

已知:①焙烧后烧渣中含+4价的铈及+3价的其它稀土氟氧化物:
②Ce4+能与SO42-结合成CeSO4,Ce4+能被萃取剂[(HA)2]萃取。
请回答下列问题:
(1)CeFCO3中,Ce元素的化合价为_____。
(2)“酸浸I”过程中CeO2转化为Ce3+,且产生黄绿色气体,用稀硫酸和H2O2,替换HCl就不会造成环境污染。则稀硫酸.H2O2与CeO2反应的离子方程式为:__________。
(3)“沉淀”步骤中发生的反应为:Ce(BF4)3(s)+3KCl(aq)=3KBF4(s)+CeCl3(aq)。已知Ce(BF4)3、KBF4的Ksp分别为a、b,则该反应的平衡常数为______(用含a、b的代数式表示)。
(4)“浸出液”中含有少量Ce4+及其他稀土元素的离子,可以通过“萃取”与“反萃取寻探作进一步分离、富集各离子。“萃取”时Ce4+与萃取剂[(HA)2]存在的反应为:Ce4++n(HA)2![]() Ce(H2a-4A2a)+4H+。用D表示Ce4+分别在有机层中与水层中存在形式的浓度之比(D=
Ce(H2a-4A2a)+4H+。用D表示Ce4+分别在有机层中与水层中存在形式的浓度之比(D=![]() )其它条件不变,在浸出液中加入不同量的NaSO4以改变水层中的c(SO42-),D随浸出液中c(SO42-)增大而减小的原因是__________。
)其它条件不变,在浸出液中加入不同量的NaSO4以改变水层中的c(SO42-),D随浸出液中c(SO42-)增大而减小的原因是__________。
(5)“操作I”后,向溶液中加入NaOH溶液,调节溶液的pH可获得Ce(OH)3沉淀,当溶液中离子浓度小于1.0×10-6mol/L视为沉淀完全,常温下加入NaOH调节溶液的pH应大于_______[已知:Ce(OH)3的Ksp=8.0×10-21;1g2=-0.3]
(6)写出“氧化”步骤的化学方程式:_______________。
(7)CeO2是汽车尾气净化催化剂的关键成分,它能在还原气氛中供氧,在氧化气氛中耗氧在尾气消除过程中发生着CeO2![]() CeO2(1-x) +xO2↑(0≤x≤0.25)的循环。写出CeO2消除CO尾气的化学方程式:________________。
CeO2(1-x) +xO2↑(0≤x≤0.25)的循环。写出CeO2消除CO尾气的化学方程式:________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com