
【题目】X、Y、Z、W四种短周期元素在元素周期表中的相对位置如图所示。其中元素Z的基态原子价电子层排布为nsn-1npn+1,下列说法正确的是
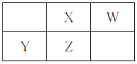
A.Y、Z、W三种元素的最高正价依次递增
B.X、Z都是第ⅥA族元素,电负性:W>X>Z
C.氢化物稳定性Z>Y>W
D.对应的简单离子半径:W>X>Z
【答案】B
【解析】
s轨道最多容纳2个电子,n-1=2,所以n=3,则Z价电子层排布为nsn-1npn+1为3s23p4,Z是S元素,根据各种元素的相对位置可知X是O,Y是 P,W是F,然后根据元素周期律分析解答。
根据上述推断可知X是O,Y是P,Z是S,W是F。
A.W元素原子半径很小,吸引电子能力很强,无最高正化合价,A错误;
B. X、Z原子核外最外层有6个电子,都是第ⅥA族元素,由于同一周期的元素,原子序数越大,元素的电负性越大;同一主族的元素,原子序数越大,元素的电负性越小,所以元素的电负性:W>X>Z,B正确;
C.元素的非金属性越强,其相应的氢化物稳定性越强。由于同一周期的元素,原子序数越大,元素的非金属性越强;同一主族的元素,原子序数越小,元素的非金属性越强,所以元素的氢化物的稳定性:W>Z>Y,C错误;
D.X、W离子核外有2个电子层,Z离子有3个电子层,对于电子层结构相同的离子来说,核电荷数越大,离子半径越小;对于电子层结构不同的离子来说,离子核外电子层数越多,离子半径越大,所以离子半径:Z>X>W,D错误;
故合理选项是B。


 高效智能课时作业系列答案
高效智能课时作业系列答案 捷径训练检测卷系列答案
捷径训练检测卷系列答案科目:高中化学 来源: 题型:
【题目】硫是一种自然界分布较广的元素,在很多化合物中都含有该元素,回答下列问题:
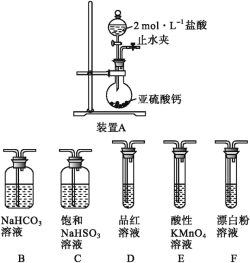
(1)装置A中反应的化学方程式为___。
(2)使分液漏斗中液体顺利流下的操作是___。
(3)选用上面的装置和药品探究亚硫酸与次氯酸的酸性强弱。
①甲同学认为按照A→C→F的顺序连接装置即可证明,乙同学认为该方案不合理,其理由是___。
②丙同学设计的合理实验方案为:A→C→___→___→D→F,其中装置C的作用是___,证明亚硫酸的酸性强于次氯酸的实验现象是___。
(4)K2S2O8具有强氧化性,可通过电解H2SO4和K2SO4的混合溶液制得,其阳极反应式为___,称取0.2500g产品置于碘量瓶中,加100mL水溶解,再加入8.000gKI固体(稍过量),振荡使其充分反应。加入适量醋酸溶液酸化,以淀粉为指示剂,用cmol·L-1的Na2S2O3标准液滴定至终点,消耗Na2S2O3标准液VmL,则样品中K2S2O8的纯度为___(用含c、V的代数式表示,已知:S2O82-+2I-=2SO42-+I2,2S2O32-+I2=S4O62-+2I-)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水仙花所含的挥发油中含有丁香油酚、苯甲醇、苯甲醛、桂皮醇等成分。它们的结构简式如下:
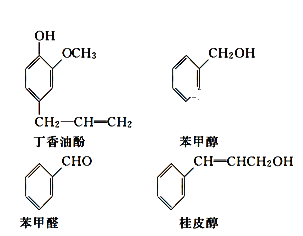
请回答下列问题:
(1)①上述四种物质中含氧的官能团有____________________________;丁香油酚可能具有的性质是_____________(填字母)。
A.可与烧碱反应 B.只能与Br2发生加成反应
C.既可燃烧,也可使酸性KMnO4溶液褪色 D.可与NaHCO3溶液反应放出CO2气体
②从结构上看,上述四种有机物中与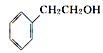 互为同系物的是___________(填名称)。
互为同系物的是___________(填名称)。
(2)苯甲醛经_______________(填反应类型)反应可得到苯甲醇。写出苯甲醛和银氨溶液反应化学方程式为__________________________________________________________________。
(3)由桂皮醇转化为丙的过程为(已略去无关产物)
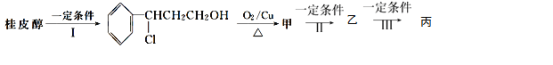
如果反应Ⅱ为消去反应,则反应Ⅱ的条件是_______________,反应Ⅲ为加聚反应,则高聚物丙的结构简式为 _________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在人类社会的发展进程中,金属起着重要的作用。
(1)以下有关金属单质的叙述正确的是_______。
A.金属钠非常活泼,在实验室中保存在石蜡油或煤油中
B.用坩埚钳夹住一小块铝箔,在酒精灯上加热,可观察到铝箔熔化,并有熔融物滴下
C.铁单质与水蒸气反应的化学方程式为2Fe+3H2O(g)=Fe2O3+3H2
(2)把NaOH、MgCl2、AlCl3三种固体组成的混合物溶于足量水后有1.16 g白色沉淀,在所得的浊液中逐滴加入1 mol·L-1 HCl溶液,加入HCl溶液的体积与生成沉淀的质量关系如下图所示,试回答:
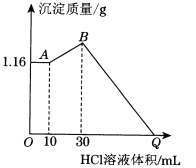
①A点的沉淀物的化学式为________;B点的沉淀物的化学式为________________________;写出A→B段发生反应的离子方程式_____________________________。
②原混合物中MgCl2的质量是________g,AlCl3的质量是________g,NaOH的质量是________g。
③Q点HCl溶液加入量是________mL。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】绿矾是含有一定量结晶水的硫酸亚铁,在工农业生产中具有重要的用途。某化学兴趣小组对绿矾的一些性质进行探究。回答下列问题:
(1)如何用实验证明绿矾中的铁是二价铁而不是三价铁_______。
(2)为测定绿矾中结晶水含量,将石英玻璃管(带两端开关K1和K2)(设为装置A)称重,记为m1g。将样品装入石英玻璃管中,再次将装置A称重,记为m2g。按如图连接好装置进行实验。
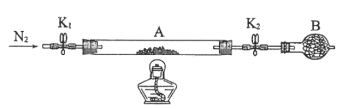
①仪器B的名称是________。
②将下列实验操作步骤正确排序_______(填标号);重复上述操作步骤,直至A恒重,记为m3g。
a.点燃酒精灯,加热 b.打开K1和K2,缓缓通入N2 c.关闭K1和K2
d.熄灭酒精灯 e.称量A f.冷却到室温
③根据实验记录,计算绿矾化学式中结晶水数目x=_______(列式表示)。若实验时按a、b次序操作,则使x_______(填“偏大”“偏小”或“无影响”)。
(3)为探究硫酸亚铁的分解产物,将(2)中已恒重的装置A接入如图所示的装置中,打开K1和K2,缓缓通入N2,加热。实验后反应管中残留固体为红色粉末。
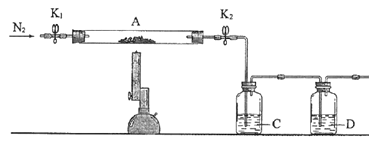
①C中的溶液为BaCl2,其作用是______。D溶液为______,D中可观察到的现象为_______。
②写出硫酸亚铁高温分解反应的化学方程式________。
③有同学认为该实验装置存在一定缺陷,请你谈谈完善该试验装置的措施____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碘循环工艺不仅能吸收SO2降低环境污染,同时又能制得氢气,具体流程如下:
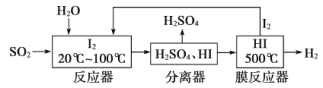
下列说法正确的是
A.分离器中的物质分离操作为过滤
B.反应器中,控制温度为20-100℃,温度过低速率慢,过高水气化且增大碘的流失,反应速率也慢
C.该工艺中I2和HI的相互转化体现了“碘循环”
D.碘循环工艺的总反应为2SO2+4H2O+I2=H2+2H2SO4+2HI
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,密闭容器中进行反应:2SO2(g)+O2(g)![]() 2SO3(g) ΔH<0。测得v正(SO2)随反应时间(t)的变化如图所示。下列有关说法正确的是( )
2SO3(g) ΔH<0。测得v正(SO2)随反应时间(t)的变化如图所示。下列有关说法正确的是( )
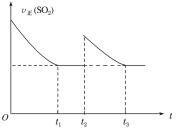
A.t2时改变的条件是:只加入一定量的SO2
B.t1时平衡常数K1大于t3时平衡常数K2
C.t1时平衡混合气体的平均相对分子质量大于t3时平衡混合气体的平均相对分子质量
D.t1时平衡混合气体中SO3的体积分数等于t3时平衡混合气体中SO3的体积分数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关溴乙烷的说法正确的是( )
A.溴乙烷的电子式![]()
B.用溴乙烷制取乙二醇经过以下几步:消去![]() 加成
加成![]() 水解
水解
C.溴乙烷与KOH醇溶液反应:CH3CH2Br+H2O![]() C2H5OH+KBr
C2H5OH+KBr
D.向溴乙烷中滴入![]() 溶液检验其中的溴元素:
溶液检验其中的溴元素:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)在苯酚钠溶液中通入少量的CO2,写出反应的化学方程式:_______________;
(2)丙酸与乙醇发生酯化反应的的化学方程式:_______________;
(3)1,2—二溴丙烷发生消去反应:_______________;
(4)甲醛和新制的银氨溶液反应:_______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com