
【题目】某小组在验证反应“Fe+2Ag+=Fe2++2Ag”的实验中检测到Fe3+,发现和探究过程如下。向硝酸酸化的0.05mol·L-1硝酸银溶液(pH≈2)中加入过量铁粉,搅拌后静置,烧杯底部有黑色固体,溶液呈黄色。
(1)检验产物:取出少量黑色固体,洗涤后,___(填操作和现象),证明黑色固体中含有Ag。
(2)针对“溶液呈黄色”,甲认为溶液中有Fe3+,乙认为铁粉过量时不可能有Fe3+,乙依据的原理是___(用离子方程式表示)。针对两种观点继续实验:

①取上层清液,滴加KSCN溶液,溶液变红,证实了甲的猜测。同时发现有白色沉淀产生,且溶液颜色深浅、沉淀量多少与取样时间有关,对比实验记录如下:
(资料:Ag+与SCN-生成白色沉淀AgSCN)
②对Fe3+产生的原因作出如下假设:
假设a:可能是铁粉表面有氧化层,能产生Fe3+;
假设b:空气中存在O2,由于___(用离子方程式表示),可氧化产生Fe3+;
假设c:酸性溶液中存在的___离子具有氧化性,可氧化产生Fe3+;
假设d:根据加入KSCN溶液后产生白色沉淀的现象,判断溶液中一定存在Ag+,Ag+可氧化Fe2+产生Fe3+。
③下述实验Ⅰ可证实假设a、b、c不是产生Fe3+的主要原因。实验Ⅱ可证实假设d成立。
实验Ⅰ:向硝酸酸化的___溶液(pH≈2)中加入过量铁粉,搅拌后静置,不同时间取上层清液滴加KSCN溶液。3min时溶液呈浅红色,30min后溶液几乎无色。
实验Ⅱ:设计实验证明假设d成立___。
(3)根据ⅰ~ⅲ实验现象,结合本题涉及的三个方程式,推测实验ⅰ~ⅲ中Fe3+浓度变化的原因(用离子方程式和文字结合表述):___。
【答案】加硝酸加热溶解固体,再滴加稀盐酸,产生白色沉淀 2Fe3++Fe=3Fe2+ 4Fe2++O2+4H+=4Fe3++2H2O NO3- 0.05mol·L-1NaNO3 分别取用不同浓度(均小于0.05mol·L-1)的硝酸银溶液与FeSO4溶液混合,取上层清液滴加KSCN溶液,观察是否变红及红色深浅,如果变红,且红色深浅与Ag+浓度大小有关,证明假设d成立 溶液中存在反应:①2Ag++Fe=Fe2++2Ag②Ag++Fe2+=Fe3++Ag③Fe+2Fe3+=3Fe2+。反应开始时,c(Ag+)大,以反应①、②为主,c(Fe3+)增大。约30min后,c(Ag+)小,以反应③为主,c(Fe3+)减小
【解析】
(1)Ag在加热条件下溶于稀硝酸,得到银离子,用氯离子检验可得;
(2)Fe过量,与铁离子价态归中得到亚铁离子;
②氧气在酸性条件下降亚铁离子氧化得到铁离子,根据电荷守恒和质量守恒书写可得;硝酸根离子在酸性条件下具有氧化性;
③证明假设abc错误,就是排除Ag+时实验比较,相当于没有Ag+存在的空白实验,考虑其他条件不要变化,可以选用NaNO3;证明d正确,则用不同浓度的硝酸银溶液与FeSO4溶液混合,与实验I类似对比不同浓度的硝酸银溶液对应的现象差异;
(3)i→ii Ag++Fe2+=Ag+Fe3+,反应生成Fe3+的使Fe3+浓度增加,ii→iii 溶液红色较3 0min时变浅,c(Ag+)小,反应为Fe+2Fe3+=3Fe2+,c(Fe3+)减小,溶液的颜色变浅。
(1)根据分析,取出少量黑色固体,洗涤后,加硝酸加热溶解固体,再滴加稀盐酸,产生白色沉淀,证明黑色固体中含有Ag;
(2)乙认为铁粉过量时不可能有Fe3+,因为过量的Fe与铁离子发生反应生成亚铁离子,反应的离子方程式为:2Fe3++Fe=3Fe2+;
②假设b:空气中存在O2,氧气在酸性条件下将亚铁离子氧化为铁离子,反应的离子方程式为:4Fe2++O2+4H+=4Fe3++2H2O;
假设c:酸性溶液中存在的NO3,硝酸具有氧化性,可氧化产生Fe3+;
③证明假设abc错误,就是排除Ag+时实验比较,相当于没有Ag+存在的空白实验,考虑其他条件不要变化,可以选用NaNO3,故实验I为:向硝酸酸化的0.05 molL1 NaNO3溶液(pH≈2)中加入过量铁粉,搅拌后静置,不同时间取上层清液滴加KSCN溶液。3 min时溶液呈浅红色,30 min后溶液几乎无色;
证明d正确,则用不同浓度的硝酸银溶液与FeSO4溶液混合,与实验I类似对比不同浓度的硝酸银溶液对应的现象差异,故实验II为:分别取用不同浓度(均小于0.05 molL1)的硝酸银溶液与FeSO4溶液混合,取上层清液滴加KSCN溶液,观察是否变红及红色深浅,如果变红,且红色深浅与Ag+浓度大小有关,证明假设d成立;
(3)溶液中存在反应:①2Ag++Fe=Fe2++2Ag②Ag++Fe2+=Fe3++Ag③Fe+2Fe3+=3Fe2+反应开始时,c(Ag+)大,以反应①、②为主,c(Fe3+)增大,约30 min后,c(Ag+)小,以反应③为主,c(Fe3+)减小。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】向含Fe2+、I-、Br-的混合溶液中通入过量的氯气,溶液中四种粒子的物质的量变化如图所示,已知b-a=5,线段Ⅳ表示一种含氧酸,且Ⅰ和Ⅳ表示的物质中含有相同的元素。下列说法正确的是( )

A.线段Ⅱ表示Br-的变化情况
B.原溶液中n(FeI2):n(FeBr2)=3:1
C.根据图像无法计算a的值
D.线段Ⅳ表示HIO3的变化情况
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯碱工业中电解饱和食盐水的原理示意图如图所示(电极均为石墨电极)。下列说法中正确的是( )

A. M为电子流出的一极
B. 通电使氯化钠发生电离
C. 电解一段时间后,阴极区pH降低
D. 电解时用盐酸调节阳极区的pH在2~3,有利于气体逸出
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一密闭烧瓶中,在25℃时存在如下平衡:2NO2(g)![]() N2O4(g) ΔH<0,将烧瓶置于100℃的水中,则下列几项性质中不会改变的是( )
N2O4(g) ΔH<0,将烧瓶置于100℃的水中,则下列几项性质中不会改变的是( )
①颜色 ②平均相对分子质量 ③质量 ④压强 ⑤密度
A.①和③B.③和⑤
C.④和⑤D.②和④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上制备纯硅反应的热化学方程式如下:SiCl4(g)+2H2(g)![]() Si(s)+4HCl(g)ΔH=+Q kJ·mol-1(Q>0),某温度、压强下,将一定量的反应物通入密闭容器进行该反应,下列叙述正确的是
Si(s)+4HCl(g)ΔH=+Q kJ·mol-1(Q>0),某温度、压强下,将一定量的反应物通入密闭容器进行该反应,下列叙述正确的是
A.反应过程中,若增大压强因为反应速率增大,所以能提高SiCl4的转化率
B.已知一定温度下,反应的平衡常数(k)为定值,向已经达到平衡状态的容器中再次加入四种物质,若![]() >k,平衡就要向正反应方向移动
>k,平衡就要向正反应方向移动
C.反应至4 min时,若HCl的浓度为0.12 mol·L-1,则H2的反应速率为0.03 mol/(L·min)
D.当反应吸收热量为0.025Q kJ时,生成的HCl可被100 mL 1 mol·L-1的NaOH溶液恰好完全吸收
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,在体积为3L的密闭容器中发生反应CO(g)+2H2(g)![]() CH3OH(g),CH3OH的物质的量与时间变化图像如图:
CH3OH(g),CH3OH的物质的量与时间变化图像如图:
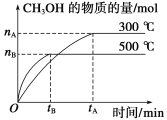
(1)该反应的平衡常数表达式K=__;
(2)降低温度,K值将__(填“增大”、“减小”或“不变”)。
(3)若起始时加入1molCO和2molH2,则达平衡时,CO和H2的转化率之比为__。
(4)500℃时,从反应开始到达到化学平衡,以H2的浓度变化表示的化学反应速率是__(用nB,tB表示)。
(5)判断该可逆反应达到化学平衡状态的标志是__(填字母,下同)。
a.CO的浓度不再变化
b.混合气体的密度不再改变
c.混合气体的平均摩尔质量不再改变
d.v生成(CH3OH)=v消耗(CO)
(6)300℃时,将容器的容积压缩到原来的![]() ,在其他条件不变的情况下,对平衡体系产生的影响是__。
,在其他条件不变的情况下,对平衡体系产生的影响是__。
a.CH3OH的物质的量增加
b.正反应速率加快,逆反应速率减慢
c.c(CO)和c(H2)均减小
d.重新平衡时![]() 减小
减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高良姜素是姜科植物高良姜根中的提取物,它能使鼠伤寒沙门氏菌TA98和TA100发生诱变,具有抗病菌作用.下列关于高良姜素的叙述正确的是( )
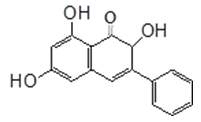
A.高良姜素的分子式为C15H15O5
B.高良姜素分子中含有3个羟基、8个双键
C.高良姜素能与碳酸钠溶液、溴水、酸性高锰酸钾溶液等反应
D.1mol高良姜素与足量的钠反应生成33.6LH2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学是一门以实验为基础的科学。
(1)用下列实验装置完成对应的实验(部分仪器略去),能达到实验目的的是_____(填字母)。
A | B | C | D |
|
|
|
|
干燥氯气 | 吸收NH3 | 石油的分馏 | 制取乙酸乙酯 |
(2)为除去粗盐中的MgCl2、CaCl2、Na2SO4以及泥沙等杂质,某同学设计了一种制备精盐的实验方案,步骤如下(用于沉淀的试剂稍过量):
称取粗盐![]() 滤液
滤液![]() 精盐
精盐
①第Ⅰ步操作的名称是______。
②若第Ⅱ、Ⅳ步顺序颠倒,是否会对实验结果产生影响?_____(填“有影响”或“无影响”)。
③第Ⅴ步操作所需玻璃仪器的名称是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镍镉(Ni-Cd)可充电电池在现代生活中有广泛应用。已知某镍镉电池的电解质溶液为KOH溶液,其充、放电按下式进行:Cd + 2NiOOH + 2H2O![]() Cd(OH)2 + 2Ni(OH)2 ,有关该电池的说法正确的是
Cd(OH)2 + 2Ni(OH)2 ,有关该电池的说法正确的是
A. 放电时电解质溶液中的OH-向正极移动
B. 充电过程是化学能转化为电能的过程
C. 放电时负极附近溶液的碱性增强
D. 充电时阳极反应:Ni(OH)2-e- + OH- = NiOOH + H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com