
| A.—44.2 kJ·mol-1 | B.+44.2 kJ·mol-1 |
| C.—330 kJ·mol-1 | D.+330 kJ·mol-1 |


科目:高中化学 来源:不详 题型:单选题
| A.12△H3+5△H2-2△H1 | B.2△H1-5△H2-12△H3 |
| C.12△H3-5△H2 -2△H1 | D.△H1-5△H2-12△H3 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.NaOH(aq)+HCl(aq)==NaCl(aq)+H2O(l);△H=" +28.7" kJ·mol-1 |
| B.NaOH(aq)+HCl(aq)==NaCl(aq)+H2O(l);△H="-28.7" kJ·mol-1 |
| C.NaOH(aq)+HCl(aq)==NaCl(aq)+H2O(l);△H=" +57.4" kJ·mol-1 |
| D.NaOH(aq)+HCl(aq)==NaCl(aq)+H2O(l);△H="-57.4" kJ·mol-1 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.40 g | B.56 g |
| C.60 g | D.无法计算 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| A.相同温度下,0.1 mol?L-1NH4Cl溶液中NH4+的浓度比0.1 mol?L-1氨水中NH4+的浓度大; |
| B.用稀盐酸洗涤AgCl沉淀比用水洗涤损耗AgCl小; |
| C.电解饱和食盐水时,阳极得到氢氧化钠溶液和氢气; |
D.对于Al(OH)3(s) Al(OH)3(aq) Al(OH)3(aq) Al3+(aq)+3OH-(aq),前段为溶解平衡,后段是电 Al3+(aq)+3OH-(aq),前段为溶解平衡,后段是电 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
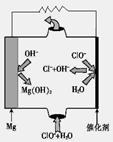
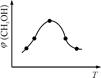
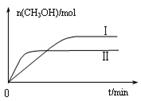
 CH3OH(g) +H2O(g) △H
CH3OH(g) +H2O(g) △H| 容 器 | 甲 | 乙 |
| 反应物 投入量 | 1molCO2 3molH2 | a molCO2、b molH2、 c molCH3OH(g)、c molH2O(g) |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.2 CO(g) + O2(g) =" 2" CO2(g) ΔH =" -" 566 KJ·mol-1 |
| B.CH4(g) + 2 O2(g) = CO2(g) + 2 H2O(l) ΔH =" -" 890 KJ·mol-1 |
| C.2 H2(g) + O2(g) =" 2" H2O(l) ΔH =" -" 571.6 KJ·mol-1 |
| D.H2(g) + Cl2(g) =" 2" HCl(g) ΔH =" -" 184.6 KJ·mol-1 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
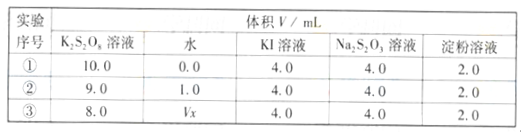
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 ② (CH3)3COH
② (CH3)3COH 查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com