
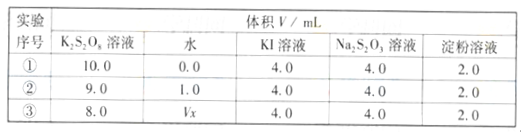
 (4) (△H1-△H2)/2(2分)
(4) (△H1-△H2)/2(2分)

 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案 目标测试系列答案
目标测试系列答案科目:高中化学 来源:不详 题型:单选题
| A.-183 kJ/mol | B.-91.5 kJ/mol | C.+183 kJ/mol | D.+91.5 kJ/mol |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.—44.2 kJ·mol-1 | B.+44.2 kJ·mol-1 |
| C.—330 kJ·mol-1 | D.+330 kJ·mol-1 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.氢气的燃烧热为-285.5kJ/mo1,则水电解的热化学方程式为: 2H2O(1) =2H2(g)+O2(g);△H=+285.5KJ/mo1 |
| B.1mol甲烷完全燃烧生成CO2和H2O(1)时放出890kJ热量,它的热化学方程式为 1/2CH4(g)+O2(g)= 1/2CO2(g)+H2O(1);△H= 一445kJ/mol |
| C.已知2C(s)+O2(g)=2CO(g);△H= 一221kJ·mol-1,则C的燃烧热为一110.5kJ/mo1 |
| D.HF与NaOH溶液反应:H+(aq)+OH—(aq)=H2O(1);△H= 一57.3kJ/mol |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 (g)+CO(g)
(g)+CO(g) CH
CH OH(g);ΔH=-90.8 kJ·mol
OH(g);ΔH=-90.8 kJ·mol
 OH(g)
OH(g) CH
CH OCH
OCH (g)+H
(g)+H O(g);ΔH=-23.5 kJ·mol
O(g);ΔH=-23.5 kJ·mol
 O (g)
O (g) CO
CO (g)+H
(g)+H (g);ΔH=-41.3 kJ·mol
(g);ΔH=-41.3 kJ·mol
 (g)+3CO(g)
(g)+3CO(g) CH
CH OCH
OCH (g)+CO
(g)+CO (g)的ΔH=__________:
(g)的ΔH=__________:
 移向__________电极(填Fe或C);
移向__________电极(填Fe或C); 氧化了生成的I
氧化了生成的I 。若反应中Cl
。若反应中Cl 和I
和I 的物质的量之比为5:1,且生成两种酸,该反应的化学方程式为:_____________________;
的物质的量之比为5:1,且生成两种酸,该反应的化学方程式为:_____________________; 溶液。
溶液。 溶液(25℃),一段时间后溶液的pH变为1,若要使溶液恢复到电解前的状态,可向溶液中加入_________(填写物质的化学式)_________g。
溶液(25℃),一段时间后溶液的pH变为1,若要使溶液恢复到电解前的状态,可向溶液中加入_________(填写物质的化学式)_________g。查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 2NH3(g) ΔH=-92.4 kJ/mol 。在同温同压下向密闭容器中通入1 mol N2和3 mol H2,反应达到平衡时放出热量为Q1 kJ;向另一体积相同的密闭容器中通人0.5 mol N2、1.5 mol H2和1 mol NH3,相同条件下达到平衡时放出热量为Q2 kJ。则下列关系式正确的是
2NH3(g) ΔH=-92.4 kJ/mol 。在同温同压下向密闭容器中通入1 mol N2和3 mol H2,反应达到平衡时放出热量为Q1 kJ;向另一体积相同的密闭容器中通人0.5 mol N2、1.5 mol H2和1 mol NH3,相同条件下达到平衡时放出热量为Q2 kJ。则下列关系式正确的是| A.2Q2=Q1=92.4 | B.Ql<Q2<92.4 | C.Q2<Q1<92.4 | D.Ql=Q2<92.4 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
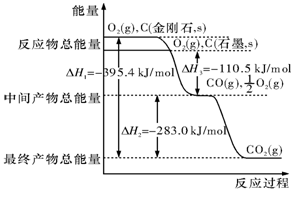
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com