
| A.40 g | B.56 g |
| C.60 g | D.无法计算 |


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源:不详 题型:单选题
| A.H2(g)+ Cl2(g)= 2HCl(g)△H =" -" 369.2kJ·mol-1 |
| B.2H2(g)+2Cl2(g)= 4HCl(g)△H =" -" 369.2kJ·mol-1 |
| C.HCl(g)= 1/2H2(g)+ 1/2Cl2(g)△H =" +" 92.3kJ·mol-1 |
| D.1/2H2(g)+ 1/2Cl2(g)= HCl(g)△H =" -" 92.3kJ·mol-1 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.-183 kJ/mol | B.-91.5 kJ/mol | C.+183 kJ/mol | D.+91.5 kJ/mol |
查看答案和解析>>
科目:高中化学 来源:不详 题型:计算题
 存在,且不与H原子直接相连。燃料的氧化剂是N2O4,燃烧产物只有CO2、H2O、N2;5.00g“偏二甲肼”完全燃烧时可放出212.5kJ热量。
存在,且不与H原子直接相连。燃料的氧化剂是N2O4,燃烧产物只有CO2、H2O、N2;5.00g“偏二甲肼”完全燃烧时可放出212.5kJ热量。查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题


查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
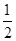 O2(g)===H2O(l) ΔH3=-285.8 kJ/mol
O2(g)===H2O(l) ΔH3=-285.8 kJ/mol| A.488.3 kJ/mol | B.-224.15 kJ/mol |
| C.-488.3 kJ/mol | D.244.15 kJ/mol |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.—44.2 kJ·mol-1 | B.+44.2 kJ·mol-1 |
| C.—330 kJ·mol-1 | D.+330 kJ·mol-1 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.氢气的燃烧热为-285.5kJ/mo1,则水电解的热化学方程式为: 2H2O(1) =2H2(g)+O2(g);△H=+285.5KJ/mo1 |
| B.1mol甲烷完全燃烧生成CO2和H2O(1)时放出890kJ热量,它的热化学方程式为 1/2CH4(g)+O2(g)= 1/2CO2(g)+H2O(1);△H= 一445kJ/mol |
| C.已知2C(s)+O2(g)=2CO(g);△H= 一221kJ·mol-1,则C的燃烧热为一110.5kJ/mo1 |
| D.HF与NaOH溶液反应:H+(aq)+OH—(aq)=H2O(1);△H= 一57.3kJ/mol |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 2NH3(g) ΔH=-92.4 kJ/mol 。在同温同压下向密闭容器中通入1 mol N2和3 mol H2,反应达到平衡时放出热量为Q1 kJ;向另一体积相同的密闭容器中通人0.5 mol N2、1.5 mol H2和1 mol NH3,相同条件下达到平衡时放出热量为Q2 kJ。则下列关系式正确的是
2NH3(g) ΔH=-92.4 kJ/mol 。在同温同压下向密闭容器中通入1 mol N2和3 mol H2,反应达到平衡时放出热量为Q1 kJ;向另一体积相同的密闭容器中通人0.5 mol N2、1.5 mol H2和1 mol NH3,相同条件下达到平衡时放出热量为Q2 kJ。则下列关系式正确的是| A.2Q2=Q1=92.4 | B.Ql<Q2<92.4 | C.Q2<Q1<92.4 | D.Ql=Q2<92.4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com