

分析 (1)已知①N2(g)+O2(g)═2NO(g)△H=+180.5kJ/mol,
②C(s)+O2(g)═CO2(g)△H=-393.5kJ/mol,
③2C(s)+O2(g)═2CO(g)△H=-221kJ/mol,
根据盖斯定律:②×2-①-③可得;
(2)①根据题找到a、b的关系式,再由化学平衡常数概念列式,代值得;保持温度不变,计算平衡后在此基础上再向容器中充入3b mol的N2、2a mol的NO的Qc,与k比较;
②根据平衡特征:正逆反应速率相等,各组分含量不再变化判断;
③根据影响化学平衡的因素作答;
(3)提高该反应的速率和NO的转化率,即要求反应正向移动;
(4)①分析图,NO2为中间产物,NO、CO、O2为反应物,CO2、N2是生成物;
②根据△G=△H-T△S,因为△H>0,△S<0,在任何情况下,都不能自发进行.
解答 解:(1)已知①N2(g)+O2(g)═2NO(g)△H=+180.5kJ/mol,
②C(s)+O2(g)═CO2(g)△H=-393.5kJ/mol,
③2C(s)+O2(g)═2CO(g)△H=-221kJ/mol,
根据盖斯定律:②×2-①-③可得:2NO(g)+2CO(g)?N2(g)+2CO2(g)的△H=-393.5kJ/mol×2-(+180.5kJ/mol)-(-221kJ/mol)=-746.5kJ/mol;
故答案为:-746.5;
(2)①反应2NO(g)+2CO(g)?N2(g)+2CO2(g).在t1时刻达到平衡状态,此时n(CO)=a mol,n(NO)=2a mol,n(N2)=b mol,则n(CO2)=2b mol,N2的体积分数为$\frac{1}{4}$,则有:$\frac{b}{2a+a+b+2b}$=
$\frac{1}{4}$,解得b=3a,K=$\frac{c({N}_{2})•c(C{O}_{2})^2}{c(NO)^2•c(CO)^2}$=$\frac{(3mol÷VL)•(6amol÷VL)^3}{(2amol÷VL)^2•(amol÷VL)^2}$=$\frac{27V}{a}$;保持温度不变,平衡后在此基础上再向容器中充入3b mol的N2、2a mol的NO,此时Qc=$\frac{(6a÷V)^2×(12a÷V)}{(4a÷V)^2•(a÷V)^2}$=$\frac{27V}{a}$=K,平衡不移动;
故答案为:$\frac{27V}{a}$;不;
②A.v生成(CO2)=v消耗(CO2),平衡时,同一物质的生成速率与消耗速率相等,A正确;
B.平衡时,各气体的体积分数不再改变,B正确;
C.混合气体的总质量不变,气体总的物质的量减小,随着反应进行,平均相对分子质量增大,平均相对分子质量不再改变,反应平衡,C正确;
D.平衡时,NO、CO、N2、CO2浓度均不再变化,D正确;
E.单位时间内生成2n mol碳氧双键的同时消耗n mol N≡N,不能说明正逆反应速率相等,E错误;
故答案选:E;
③在t2时刻,将容器迅速压缩,则对原平衡为增大压强,反应速率加快,该反应是个体积减小的反应,增大压强,平衡正向移动,正反应速率减慢至不再改变,故图象为: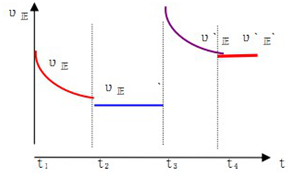 ;
;
故答案为;
(3)提高该反应的速率和NO的转化率,即要求反应正向移动,
A.降低温度,反应速率减慢,故错误;B.增大压强同时加催化剂,速率加快,反应正向移动,NO的转化率提高,故正确;C.升高温度同时充入N2,该反应是放热反应,逆向移动,转化率减小,故错误;D.及时将CO2和N2从反应体系中移走,反应正向移动,转化率增大,但是反应速率减小,故错误;
故答案为:B;
(4)①分析图,NO2为中间产物,NO、CO、O2为反应物,CO2、N2是生成物,则反应为:2NO+O2+4CO$\frac{\underline{\;催化剂\;}}{\;}$4CO2+N2;
故答案为:2NO+O2+4CO$\frac{\underline{\;催化剂\;}}{\;}$4CO2+N2;
②根据△G=△H-T△S,因为△H>0,△S<0,在任何情况下,△G>0,不能自发进行..
故答案为:因为△H>0,△S<0,在任何情况下,都不能自发进行.
点评 本题涉及热化学盖斯定律的应用、化学平衡的有关计算、化学平衡状态的判断等方面的知识,属于综合知识的考查题,难度大.


科目:高中化学 来源: 题型:选择题
| A. | 第六周期,ⅣA族 | B. | 第七周期,ⅣA族 | C. | 第六周期,ⅢA族 | D. | 第七周期,ⅢA族 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 黑色沉淀完全转化为白色沉淀 | B. | 既有氯化银也有硫化银 | ||
| C. | 只产生黑色硫化银沉淀 | D. | 只有氯化银白色沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
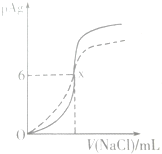 已知pAg=-lg(Ag+),Ksp(AgCl)=1×10-12.如图是向10ml AgNO3溶液中逐渐加入0.1mol/L的NaCl溶液时,溶液的pAg随着加入NaCl溶液的体积变化的图象(实线).根据图象所得下列结论正确的是[提示:Ksp(AgCl)>Ksp(AgI)]( )
已知pAg=-lg(Ag+),Ksp(AgCl)=1×10-12.如图是向10ml AgNO3溶液中逐渐加入0.1mol/L的NaCl溶液时,溶液的pAg随着加入NaCl溶液的体积变化的图象(实线).根据图象所得下列结论正确的是[提示:Ksp(AgCl)>Ksp(AgI)]( )| A. | 相同温度下,AgCl在纯水和在NaCl溶液中的溶解度相等 | |
| B. | 原AgNO3溶液的物质的量浓度为0.1mol/L | |
| C. | 图中x的坐标为(100,6) | |
| D. | 0.1mol/L的NaCl溶液换成0.1mol/L的NaI溶液时,图象变为虚线部分 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
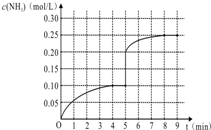 在一容积为1L的密闭容器内加入0.1mol的N2和0.3mol的H2,在一定条件下发生如下反应:N2(g)+3H2(g)?2NH3(g)△H<0,反应中NH3的物质的量浓度的变化情况如图:
在一容积为1L的密闭容器内加入0.1mol的N2和0.3mol的H2,在一定条件下发生如下反应:N2(g)+3H2(g)?2NH3(g)△H<0,反应中NH3的物质的量浓度的变化情况如图:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
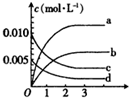 在2L密闭容器内,80℃时反应:2NO(g)+O2(g)?2NO2(g),反应体系中,n(NO)随时间t的变化如表
在2L密闭容器内,80℃时反应:2NO(g)+O2(g)?2NO2(g),反应体系中,n(NO)随时间t的变化如表| 时间t(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)(mol) | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{{20M×{{10}^{-3}}}}{127}$g | B. | 20M g | C. | $\frac{{20×{{10}^{-3}}}}{M}$g | D. | $\frac{20}{M}$g |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 推广使用无磷洗衣粉,以减少水体富营养化 | |
| B. | PM2.5是指大气中直径接近于2.5μm(1m=106μm=109nm)的颗粒物,也称可吸入颗粒物,这些细颗粒物分散在空气中形成的分散系是胶体 | |
| C. | 为提高农作物产量大量使用农药和化肥 | |
| D. | 对农作物秸秆进行焚烧还田,以增加土壤肥力 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com