
| A. | 水玻璃中通入过量二氧化硫:Na2SiO3+SO2+H2O═2Na++SO32-+H2SiO3↓ | |
| B. | 铁屑溶于过量稀硝酸:3Fe+8H++2NO3-═3Fe2++2NO↑+4H2O | |
| C. | 往碳酸钙中滴加稀盐酸:CO32-+2H+═H2O+CO2↑ | |
| D. | 在NaOH溶液中加入少量Ca(HCO3)2溶液:Ca2++2HCO3-+2OH -═CaCO3↓+CO32-+2H2O |
分析 A.二氧化硫过量,反应生成亚硫酸氢钠,硅酸钠为可溶性盐,应拆成离子形式;
B.硝酸过量反应生成三价铁离子;
C.碳酸钙为沉淀,应保留化学式;
D.碳酸氢钙少量,反应生成碳酸钙、碳酸钠和水.
解答 解:A.水玻璃中通入过量二氧化硫,离子方程式:SiO32-+2SO2+2H2O═2HSO3-+H2SiO3↓,故A错误;
B.铁屑溶于过量稀硝酸,离子方程式:Fe+4H++NO3-═Fe3++NO↑+2H2O,故B错误;
C.往碳酸钙中滴加稀盐酸,离子方程式:CaCO3+2H+═H2O+CO2↑+Ca2+,故C错误;
D.在NaOH溶液中加入少量Ca(HCO3)2溶液,离子方程式:Ca2++2HCO3-+2OH -═CaCO3↓+CO32-+2H2O,故D正确;
故选:D.
点评 本题考查了离子方程式的书写,明确物质的性质及离子方程式书写方法是解题关键,注意离子反应遵循客观事实,遵循原子个数守恒规律,题目难度不大.


科目:高中化学 来源: 题型:解答题
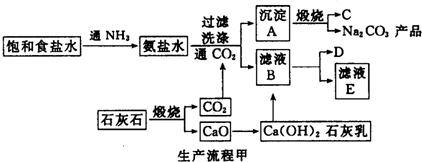

查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| 选项 | 实验操作和现象 | 结论 |
| A | 室温下,向苯酚钠溶液中滴入NaHSO3溶液,出现白色浑浊 | C6H5O-结合质子的能力比SO32-强 |
| B | 向待测液X中依次滴入氯水、KSCN溶液,溶液变红 | 待测液X中一定含有Fe2+ |
| C | 向(NH4)2S2O8溶液中加入硝酸酸化的Mn(NO3)2溶液和1滴AgNO3溶液(作催化剂),微热,溶液变紫色 | S2O82-氧化性比MnO4-强 |
| D | 浓硫酸与乙醇共热产生的气体Y,通入酸性KMnO4溶液,溶液紫色褪去 | 气体Y为纯净的乙烯 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
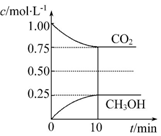
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | (m-16)g | B. | (m+16)g | C. | (m-32)g | D. | 16g |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 离子或分子 | 要 求 |
| A | K+、SO42-、Cl-、HS- | c(K+)<c(SO42-) |
| B | Fe3+、Na+、NO3-、ClO- | 溶液pH=1 |
| C | Na+、Al3+、Cl-、SO42- | 滴加氨水立即有沉淀产生 |
| D | NH4+、Ba2+、NO3-、CH3COOH | 滴加NaOH溶液立即有气泡产生 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 实验编号 | 温度/℃ | 起始时物质的量/mol | 平衡时物质的量/mol | |
| n(X) | n(Y) | n(M) | ||
| ① | 700 | 0.40 | 0.10 | 0.090 |
| ② | 800 | 0.10 | 0.40 | 0.080 |
| ③ | 800 | 0.20 | 0.20 | a |
| ④ | 800 | 0.10 | 0.10 | b |
| A. | 实验①中,若5min时测得n(M)=0.050mol,则0至5min时间内,用N表示的平均反应速率υ(N)=1.0×10-2mol/(L•min) | |
| B. | 实验②中,该反应的平衡常数K=2.0 | |
| C. | 实验③中,达到平衡时,X的转化率为50% | |
| D. | 实验④中,达到平衡时,b<0.05 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com