
| 实验编号 | 温度/℃ | 起始时物质的量/mol | 平衡时物质的量/mol | |
| n(X) | n(Y) | n(M) | ||
| ① | 700 | 0.40 | 0.10 | 0.090 |
| ② | 800 | 0.10 | 0.40 | 0.080 |
| ③ | 800 | 0.20 | 0.20 | a |
| ④ | 800 | 0.10 | 0.10 | b |
| A. | 实验①中,若5min时测得n(M)=0.050mol,则0至5min时间内,用N表示的平均反应速率υ(N)=1.0×10-2mol/(L•min) | |
| B. | 实验②中,该反应的平衡常数K=2.0 | |
| C. | 实验③中,达到平衡时,X的转化率为50% | |
| D. | 实验④中,达到平衡时,b<0.05 |
分析 A.根据v=$\frac{△c}{△t}$计算v(M),再利用速率之比等于化学计量数之比计算v(N);
B.由表中数据,计算平衡时其它组分的物质的量,由于反应中气体的化学计量数相等,可以用物质的量代替浓度代入平衡常数表达式K=$\frac{c(M)×c(N)}{c(X)×c(Y)}$计算;
C.温度不变平衡常数不变,用a表示出平衡时各组分物质的量,再根据平衡常数列方程计算解答;
D.实验①、②若温度相同,X、Y按1:1反应,二者物质的量相互交换,平衡时生成物物质的量相等,实验②中温度较高,平衡时M的物质的量减小,说明升高温度平衡逆向移动,则正反应为放热反应,若④的温度为800℃,恒容体系中,气体体积不变的反应,实验④与③为等效平衡,平衡时b=$\frac{1}{2}$a,但④的实际温度为900℃,相比较800℃,平衡逆向移动,则b<$\frac{1}{2}$a.
解答 解:A.速率之比等于化学计量数之比,则v(N)=v(M)=$\frac{△c}{△t}$=$\frac{\frac{0.05mol}{10L}}{5min}$=1.0×10-3mol/(L•min),故A错误;
B. X(g)+Y(g)?M(g)+N(g)
起始(mol):0.1 0.4 0 0
转化(mol):0.08 0.08 0.08 0.08
平衡(mol):0.02 0.32 0.08 0.08
由于反应中气体的化学计量数相等,可以用物质的量代替浓度计算平衡常数,故实验②中,该反应的平衡常数K=$\frac{c(M)×c(N)}{c(X)×c(Y)}$=$\frac{0.08×0.08}{0.02×0.32}$=1,故B错误;
C. 温度不变平衡常数不变,平衡时M为amol,则:
X(g)+Y(g)?M(g)+N(g)
起始(mol):0.2 0.2 0 0
转化(mol):a a a a
平衡(mol):0.2-a 0.2-a a a
则K=$\frac{a×a}{(0.2-a)×(0.2-a)}$=1,解得a=0.1,实验③中,X的转化率=$\frac{0.1}{0.2}$×100%=50%,故C正确;
D.实验①、②若温度相同,X、Y按1:1反应,二者物质的量相互结合,平衡时生成物物质的量相等,实验②中温度较高,平衡时M的物质的量减小,说明升高温度平衡逆向移动,则正反应为放热反应,若④的温度为800℃,恒容体系中,气体体积不变的反应,实验④与③为等效平衡,平衡时b=$\frac{1}{2}$a=0.05mol,但④的实际温度为900℃,相比较800℃,平衡逆向移动,则b<0.05,故D错误.
故选C.
点评 本题考查化学平衡计算、化学反应速率、化学平衡常数、化学平衡的影响因素等,为高频考点,侧重于学生的分析能力和计算能力的考查,难度中等,D选项为易错点,注意利用等效思想解答.


科目:高中化学 来源: 题型:选择题
| A. | 水玻璃中通入过量二氧化硫:Na2SiO3+SO2+H2O═2Na++SO32-+H2SiO3↓ | |
| B. | 铁屑溶于过量稀硝酸:3Fe+8H++2NO3-═3Fe2++2NO↑+4H2O | |
| C. | 往碳酸钙中滴加稀盐酸:CO32-+2H+═H2O+CO2↑ | |
| D. | 在NaOH溶液中加入少量Ca(HCO3)2溶液:Ca2++2HCO3-+2OH -═CaCO3↓+CO32-+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 酸性氧化物 干冰 CO2 | B. | 碱 纯碱 Na2CO3 | ||
| C. | 酸 硫酸 H2SO3 | D. | 单质 氯水 Cl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | A | B | C | D |
| 第一次加入 | Al | Na | Zn | Mg |
| 第二次加入 | K | Mg | Al | Cu |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
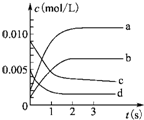 在2L密闭容器中,在800℃下反应2NO(g)+O2(g)?2NO2(g)体系中,n(NO)随时间的变化如表:
在2L密闭容器中,在800℃下反应2NO(g)+O2(g)?2NO2(g)体系中,n(NO)随时间的变化如表:| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)/mol | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| Ka1 | Ka2 | |
| H2SO3 | 1.3×10-2 | 6.3×10-8 |
| H2CO3 | 4.2×10-7 | 5.6×10-11 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
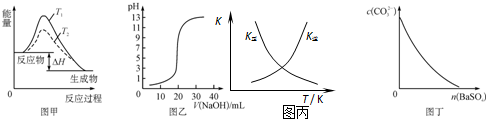
| A. | 图甲表示温度T1>T2,SO2与O2反应过程中的能量变化 | |
| B. | 图乙表示0.100 0 mol/L NaOH溶液滴定20.00 mL 0.100 0 mol/L CH3COOH溶液所得到的滴定曲线 | |
| C. | 图丙表示恒容密闭容器中反应“2SO2(g)+O2(g)?2SO3(g)△H<0”的平衡常数K正、K逆随温度的变化 | |
| D. | 图丁表示在饱和Na2CO3溶液中逐步加BaSO4固体后,溶液中c(CO32-)的浓度变化 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com