
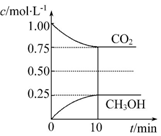
���� ��1������ɫ�����Ӳ�����ʵ������ж��Ƿ���ڣ�
��2���������ϡ���ᣬ�а�ɫ�������ɣ��ټ������ϡ���ᣬ��������ʧ��˵������Ag+��
��3���ܺ�NaOH��Һ��Ӧ��������Mg2+��
��4����Һ��һ���������ӣ��������ӽ�����ɳ����IJ��ܴ��ڣ�
��� �⣺��1������ɫ�����Ӳ�����ʵ������ж��Ƿ���ڣ���Һ��ɫ˵������Cu2+��Fe3+���ʴ�Ϊ��Cu2+��Fe3+��
��2���������ϡ���ᣬ�а�ɫ�������ɣ��ټ������ϡ���ᣬ��������ʧ��˵������Ag+�����ӷ�Ӧ����ʽΪ��Ag++Cl-=AgCl�����ʴ�Ϊ��Ag+��Ag++Cl-=AgCl����
��3���ܺ�NaOH��Һ��Ӧ��������Mg2+�����ӷ�Ӧ����ʽΪMg2++2OH-�TMg��OH��2�����ʴ�Ϊ��Mg2+��Mg2++2OH-�TMg��OH��2����
��4��ԭ��Һ�д���Ag+����Cl- ���ܹ��棬ԭ��Һ�п϶���Mg2+����CO32-��OH-�������乲�棬��������Ӳ����������κ��������ɳ���������Һ�п��ܴ������ڵ���������������ʴ�Ϊ��B��
���� ���⿼��������ƶϣ�Ϊ��Ƶ���㣬���ؿ������ӵķ�Ӧ���ƶϣ��������ӵ���ɫ������֮��ķ�Ӧ���������֪�������ӡ��������ӡ���������ӡ������ӡ�笠����ӵļ��鷽����������Ŀ�ѶȲ���



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| ѡ�� | ���ӻ���� | Ҫ �� |
| A | K+��SO42-��Cl-��HS- | c��K+����c��SO42-�� |
| B | Fe3+��Na+��NO3-��ClO- | ��ҺpH=1 |
| C | Na+��Al3+��Cl-��SO42- | �μӰ�ˮ�����г������� |
| D | NH4+��Ba2+��NO3-��CH3COOH | �μ�NaOH��Һ���������ݲ��� |
| A�� | A | B�� | B | C�� | C | D�� | D |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 2.4 gþ��������O2��ȼ�գ�ת�Ƶĵ�����Ϊ0.1 NA | |
| B�� | ��������ΪNA��NO2��CO2��������к��е���ԭ����Ϊ2 NA | |
| C�� | 1 Lһ����̼����һ����1 L����������С | |
| D�� | ���³�ѹ�£�8 g O3�к���8 NA������ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ���������ݻ����䣬�����м���1 mol N2��N2���μӷ�Ӧ������Ӧ���ʼӿ� | |
| B�� | �����ʼ�ķ�Ӧ�¶ȣ�����Ӧ���ʼӿ죬�淴Ӧ���ʼ�����ƽ�������ƶ� | |
| C�� | ��������������ѹǿ���䣬�����м���1 mol Ne����Ӧ���ʼӿ죬ƽ�������ƶ� | |
| D�� | ��������������ѹǿ���䣬�����м���1 mol H2��g����1 mol I2��g������Ӧ���ʲ��� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| ʵ���� | �¶�/�� | ��ʼʱ���ʵ���/mol | ƽ��ʱ���ʵ���/mol | |
| n��X�� | n��Y�� | n��M�� | ||
| �� | 700 | 0.40 | 0.10 | 0.090 |
| �� | 800 | 0.10 | 0.40 | 0.080 |
| �� | 800 | 0.20 | 0.20 | a |
| �� | 800 | 0.10 | 0.10 | b |
| A�� | ʵ����У���5minʱ���n��M��=0.050mol����0��5minʱ���ڣ���N��ʾ��ƽ����Ӧ���ʦԣ�N��=1.0��10-2mol/��L•min�� | |
| B�� | ʵ����У��÷�Ӧ��ƽ�ⳣ��K=2.0 | |
| C�� | ʵ����У��ﵽƽ��ʱ��X��ת����Ϊ50% | |
| D�� | ʵ����У��ﵽƽ��ʱ��b��0.05 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
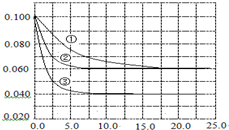 ����Һ�У���ӦA+2B?C�ֱ������ֲ�ͬʵ�������½��У����ǵ���ʼŨ�Ⱦ�Ϊc��A��=0.100mol•L-1��c��B��=0.200mol•L-1��c��C��=0mol•L-1����Ӧ��A��Ũ����ʱ��ı仯��ͼ��ʾ������˵����ȷ���ǣ�������
����Һ�У���ӦA+2B?C�ֱ������ֲ�ͬʵ�������½��У����ǵ���ʼŨ�Ⱦ�Ϊc��A��=0.100mol•L-1��c��B��=0.200mol•L-1��c��C��=0mol•L-1����Ӧ��A��Ũ����ʱ��ı仯��ͼ��ʾ������˵����ȷ���ǣ�������| A�� | ��ӦA+2B?C�ġ�H��0 | |
| B�� | ����Ӧ�١��ڵ�ƽ�ⳣ���ֱ�ΪK1��K2����K1��K2 | |
| C�� | ʵ���ƽ��ʱB��ת����Ϊ60% | |
| D�� | ��С��Ӧ�۵�ѹǿ������ʹƽ��ʱc��A��=0.060 mol•L-1 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
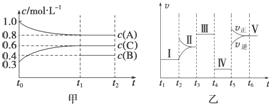 ��ij�ܱ������м��� 4mol A��1.2mol C ��һ������ B �������壬һ������ �·�����Ӧ�������ʵ�Ũ����ʱ��仯���ͼ��ʾ[��֪ t0��t1 �α��ֺ��¡����ݣ��� c��B��δ����]����ͼΪ t2 ʱ�̺�ı䷴Ӧ��������Ӧ������ʱ��ı仯�������֪ �� t2��t3��t4��t5 ʱ�̸��ı�һ�ֲ�ͬ������������ t3 ʱ��Ϊʹ�ô�����
��ij�ܱ������м��� 4mol A��1.2mol C ��һ������ B �������壬һ������ �·�����Ӧ�������ʵ�Ũ����ʱ��仯���ͼ��ʾ[��֪ t0��t1 �α��ֺ��¡����ݣ��� c��B��δ����]����ͼΪ t2 ʱ�̺�ı䷴Ӧ��������Ӧ������ʱ��ı仯�������֪ �� t2��t3��t4��t5 ʱ�̸��ı�һ�ֲ�ͬ������������ t3 ʱ��Ϊʹ�ô������鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com