
【题目】2001年报道硼和镁形成的化合物刷新了金属化合物超导温度的最高记录.如图示意的是该化合物的晶体结构单元:镁原子间形成正六棱柱,且棱柱的上下底面各有一个镁原子,6个硼原子位于棱柱内,则该化合物的化学式可表示为( )
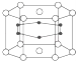
A. MgBB. MgB2C. Mg2BD. Mg3B2
 新思维假期作业暑假吉林大学出版社系列答案
新思维假期作业暑假吉林大学出版社系列答案 蓝天教育暑假优化学习系列答案
蓝天教育暑假优化学习系列答案科目:高中化学 来源: 题型:
【题目】(1)4.8gO3和0.2molCH4,在同温同压下的体积之比是__;相同质量的O2和SO2,所含分子的数目之比为__,所含O原子的物质的量之比为__,密度之比为__。
(2)标准状况下11.2 L N2所含分子数是___个。
(3)若某原子的摩尔质量是M g/mol,则一个该原子的真实质量是__g。
(4)483g Na2SO4·10H2O中所含的Na+的物质的量是__,SO42-的物质的量是__,所含H2O分子的数目是___个。
(5)现有100 ml 1.00 mol/L NaCl溶液,其中所含Na+的质量是___g。
(6)下列物质能导电是__,属于电解质是__,属于非电解质的是__。(填序号,多选或错选扣分)①水银 ②烧碱 ③硫酸钡 ④氯化钠晶体 ⑤盐酸 ⑥蔗糖
(7)实验室配制480mL0.08mol/LNa2CO3溶液,需要十水碳酸钠晶体质量_______g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了将混有Na2SO4、NaHCO3的NaCl固体提纯,制得纯净的氯化钠溶液,某学生设计了如下图所示的实验方案:

已知碳酸氢钠在加热条件下能分解成碳酸钠、二氧化碳和水,而NaCl和Na2SO4固体加热时不发生化学变化。请回答下列问题:
(1)操作①盛放药品可选用___________(填仪器名称)。
(2)操作②为什么不用Ba(NO3)2溶液,其理由是:___________________________。
(3)进行操作②后,判断SO42-已除尽的方法是:______________________________。
(4)操作③的目的是:____________________________________________________。
(5)此设计方案是否严密___________(填“是”或“否”)理由_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】同温同压下,等质量的CO和CO2相比,下列叙述中正确的是
A.所含碳原子数比为1:1 B.体积比为7:11
C.密度比为7:11 D.分子数比为7:11
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知氢硫酸是一种二元弱酸,请回答以下问题:
(1)已知 0.1mol/L NaHS 溶液显碱性,则c(S2—)___c(H2S)(填“>”“<”或“=”)。
(2)常温下,向 0.2mol/L的 H2S溶液中逐滴滴入 0.2mol/L NaOH 溶液至中性,此时溶液中以下所示关系不正确的是___(填字母)。
A. c(H+)·c(OH-)=1×10-14
B. c(Na+)=c(HS—)+2c(S2—)
C. c(Na+)> c(HS—)+c(S2—)+ c(H2S)
D. c(H2S)> c(S2—)
(3)已知常温下,CaS 饱和溶液中存在平衡CaS(s) ![]() Ca2+(aq)+S2-(aq) △H>0。
Ca2+(aq)+S2-(aq) △H>0。
①温度升高时,KSP(CaS ) =___ (填“增大”“减少”或“不变”,下同)。
②滴加少量浓盐酸时,c(Ca2+ )___,原因是___(用文字和离子方程式说明)。
③若向CaS 饱和溶液中加入Cu(NO3)2 溶液中,生成一种黑色固体物质,写出该过程中反应的离子方程式:___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,将浓度均为![]() 、体积分别为
、体积分别为![]() 和
和![]() 的
的![]() 溶液与
溶液与![]() 溶液按不同体积比混合,保持
溶液按不同体积比混合,保持![]() ,
,![]() 、
、![]() 与混合液的
与混合液的![]() 的关系如图所示。下列说法正确的是( )
的关系如图所示。下列说法正确的是( )
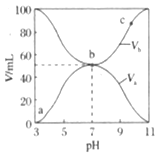
A. ![]()
B. b点,![]()
C. a、b、c三点,c点时水电离出的![]() 最大
最大
D. ![]() 点过程中,可能存在
点过程中,可能存在![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述变化理论上计量结果正确的是( )
A. 标准状况下,用含空气和氨气体积各半的烧瓶进行喷泉实验,所得溶液的物质的量浓度约为![]()
B. 相同质量的两份铝,分别放入足量的![]() 和
和![]() 溶液中充分反应,消耗的
溶液中充分反应,消耗的![]() 和
和![]() 之比为1∶1
之比为1∶1
C. 将![]() 逐滴加入到
逐滴加入到![]() 溶液中,产生
溶液中,产生![]() 的体积约为
的体积约为![]() (标准状况下)
(标准状况下)
D. 向![]() 的
的![]() 溶液中通入足量的
溶液中通入足量的![]() 气体,生成
气体,生成![]() 沉淀
沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是盛放浓硫酸试剂瓶标签上的部分内容。现用该浓硫酸配制240 mL 1.0 mol·L-1的稀硫酸。请回答下列问题:

(1)配制上述稀硫酸时,可供选用的仪器有:①玻璃棒;②烧瓶;③烧杯;④药匙;⑤量筒;⑥托盘天平;⑦胶头滴管。还缺少的仪器有______________(写仪器名称);
(2)容量瓶上除有刻度线外还应标有____________,在使用前必须检查容量瓶是否____________。
(3)配制240 mL 1.0 mol·L-1的稀硫酸需要用量筒量取上述浓硫酸,量取浓硫酸时应选用以下_____规格的量筒(填选项)。
A.10 mL B.25 mL C.50 mL D.100 mL
(4)配制过程有以下操作:
A.移液 B.量取 C.洗涤 D.定容 E.稀释 F.摇匀 G.计算
其正确的操作顺序应是______________(填序号)。
(5)经过测定,某同学配制的稀硫酸浓度偏低,则可能的原因是_______(填序号)
①用量筒量取浓硫酸时,仰视刻度线
②容量瓶用蒸馏水洗涤后未经干燥
③洗涤烧杯内壁和玻璃棒后将洗涤液倒入废液缸
④转移溶液时,不慎有少量溶液洒出
⑤定容时,俯视容量瓶刻度线
⑥摇匀后发现溶液的凹液面低于刻度线,再加蒸馏水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了探究Cl2、SO2同时通入H2O中发生的反应,某校化学兴趣小组同学设计了如图所示的实验装置。

(1)气体发生装置B产生的气体是________。
(2)为验证通入装置D中的气体是Cl2过量还是SO2过量,某小组同学准备了以下试剂:
①氯化亚铁溶液 ②硫氰化钾溶液 ③品红溶液 ④酸性高锰酸钾溶液
a.若Cl2过量:取适量D中溶液滴加至盛有__________(选填一个序号)的试管内,再加入________(选填一个序号)试剂,实验现象是_______________________________。
b.若SO2过量:取适量D中溶液滴加至盛有__________(选填一个序号)的试管内,实验现象是________________________________________。
(3)另一小组设计如图所示的装置图(夹持和加热装置略去),分别研究SO2和Cl2的性质。
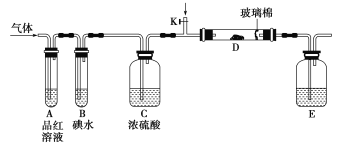
①若从左端分别通入SO2和Cl2,装置A中观察到的现象是否相同?_________(填“相同”或“不相同”);
②若装置B中装有5.0 mL 1.0 mol·L-1碘水,当通入足量Cl2完全反应后,共转移了0.05mol电子,该反应的化学方程式为________________________________。
(4)若由元素S和O组成-2价酸根离子X,X中S和O的质量比为4∶3;当Cl2与含X的溶液完全反应后,有浅黄色沉淀生成,取上层清液加入氯化钡溶液,有白色沉淀产生。写出Cl2与含X的溶液反应的离子方程式:_____________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com