
【题目】(1)4.8gO3和0.2molCH4,在同温同压下的体积之比是__;相同质量的O2和SO2,所含分子的数目之比为__,所含O原子的物质的量之比为__,密度之比为__。
(2)标准状况下11.2 L N2所含分子数是___个。
(3)若某原子的摩尔质量是M g/mol,则一个该原子的真实质量是__g。
(4)483g Na2SO4·10H2O中所含的Na+的物质的量是__,SO42-的物质的量是__,所含H2O分子的数目是___个。
(5)现有100 ml 1.00 mol/L NaCl溶液,其中所含Na+的质量是___g。
(6)下列物质能导电是__,属于电解质是__,属于非电解质的是__。(填序号,多选或错选扣分)①水银 ②烧碱 ③硫酸钡 ④氯化钠晶体 ⑤盐酸 ⑥蔗糖
(7)实验室配制480mL0.08mol/LNa2CO3溶液,需要十水碳酸钠晶体质量_______g。
【答案】1:2 2:1 2:1 1:2 0.5NA ![]() 3mol 1.5mol 15 NA 2.3g ①⑤ ②③④ ⑥ 11.44g
3mol 1.5mol 15 NA 2.3g ①⑤ ②③④ ⑥ 11.44g
【解析】
(1)同温同压下的气体的体积之比等于物质的量之比,4.8gO3的物质的量为n=![]() =
=![]() =0.1mol,则0.1mol O3和0.2molCH4的体积之比等于物质的量之比为1:2,根据n=
=0.1mol,则0.1mol O3和0.2molCH4的体积之比等于物质的量之比为1:2,根据n=![]() 可知,设O2和SO2的质量都为1g,它们的物质的量之比=
可知,设O2和SO2的质量都为1g,它们的物质的量之比=![]() :
:![]() =64g/mol:32g/mol= 2:1;根据N=nNA可知,O2和SO2所含分子数目之比=2:1;一个O2和SO2分子均由两个O原子构成,O2和SO2物质的量之比=2:1;所含O原子的物质的量之比为2:1;同温同压下,气体的密度之比等于摩尔质量之比= 32 g/mol:64 g/mol =1:2,
=64g/mol:32g/mol= 2:1;根据N=nNA可知,O2和SO2所含分子数目之比=2:1;一个O2和SO2分子均由两个O原子构成,O2和SO2物质的量之比=2:1;所含O原子的物质的量之比为2:1;同温同压下,气体的密度之比等于摩尔质量之比= 32 g/mol:64 g/mol =1:2,
故答案为1:2;2:1;2:1;1:2;
(2)根据n=![]() ,标准状况下11.2 L N2所含分子的物质的量=
,标准状况下11.2 L N2所含分子的物质的量=![]() =0.5mol,1mol任何物质具有的微粒数是NA,0.5mol N2所含分子的数目为0.5NA,
=0.5mol,1mol任何物质具有的微粒数是NA,0.5mol N2所含分子的数目为0.5NA,
故答案为:0.5NA;
(3)根据摩尔质量知,1mol该原子的质量是Mg,1mol原子有阿伏加德罗常数NA个,即NA个原子的质量是Mg,则一个该原子的真实质量约为![]() g,
g,
故答案为:![]() ;
;
(4)483g Na2SO4·10H2O的物质的量=![]() =1.5mol,Na+的物质的量为Na2SO4·10H2O的2倍为1.5mol×2=3mol,硫酸根离子物质的量等于Na2SO410H2O的物质的量,为1.5mol;H2O分子的物质的量为Na2SO410H2O的10倍为1.5mol×10=15mol,故所含水分子数目为15NA,
=1.5mol,Na+的物质的量为Na2SO4·10H2O的2倍为1.5mol×2=3mol,硫酸根离子物质的量等于Na2SO410H2O的物质的量,为1.5mol;H2O分子的物质的量为Na2SO410H2O的10倍为1.5mol×10=15mol,故所含水分子数目为15NA,
答案为:3mol;1.5mol;15 NA;
(5)100 ml 1.00 mol/L NaCl溶液中,根据公式n=cV,NaCl的物质的量=1 mol/L×0.1L=0.1mol,Na+的物质的量也是0.1mol,则所含Na+的质量=0.1mol×23g/mol=2.3 g,
故答案为:2.3g;
(6)①水银为金属单质汞,含有自由移动的电子,可导电,但不是化合物,既不是电解质也不是非电解质;②烧碱是氢氧化钠,没有自由移动的离子,不能导电,其水溶液可电离出离子能导电,属于电解质;③硫酸钡没有自由移动的离子,不能导电,其熔融状态下可电离出离子能导电,属于电解质;④氯化钠晶体没有自由移动的离子,不能导电,其水溶液可电离出离子能导电,属于电解质;⑤盐酸是溶液,含有自由移动的离子可导电,但不是化合物,既不是电解质也不是非电解质;⑥蔗糖没有自由移动的离子,不能导电,其水溶液和熔融状态下都不能电离出离子,不导电,属于非电解质;
则物质能导电是①⑤,属于电解质是②③④,属于非电解质的是⑥,
故答案为:①⑤;②③④;⑥;
(7)实验室配制480mL0.08mol/LNa2CO3溶液,用500 mL容量瓶,Na2CO3的物质的量=cV=0.08mol/L×0.5L=0.04mol,Na2CO3·10H2O的摩尔质量为286g/mol,需要Na2CO3·10H2O的质量=nM=0.04 mol ×286g/mol=11.44g
故答案为:11.44。


科目:高中化学 来源: 题型:
【题目】已知SiO2、SO2和CO2都是酸性氧化物,化学性质具有一定的相似性;Mg和Na的化学性质也具有一定的相似性。
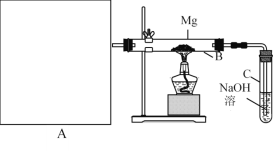
Ⅰ.用上图所示装置进行Mg和SO2的实验,其中A是制备SO2的发生装置。用80%的H2SO4溶液与Na2SO3固体制取SO2 。
(1) 写出装置B中发生的主要反应的化学方程式_____________________。装置C中NaOH溶液的作用是___。
(2)你认为该装置不足之处是什么?__________________________只要答出两点即可)。
Ⅱ.某研究性学习小组进行了“实验室制Si”的研究,它们以课本为基础,查阅资料得到以下可供参考的信息:①工业上在高温时用C还原SiO2可制得Si ②Mg在点燃的条件下即可与SiO2反应 ③金属硅化物与稀H2SO4反应生成硫酸盐与SiH4④Si和SiO2均不与稀H2SO4反应 ⑤SiH4在空气中自燃他们在研究报告中记载着“……选用合适的物质在适宜的条件下充分反应;再用足量稀硫酸溶解固体产物;然后过滤、洗涤、干燥;最后称量……在用稀硫酸溶解固体产物时,发现有爆鸣声和火花,其产率也只有预期值的63%左右”。
(3) 该小组“实验室制Si”的化学方程式是______________________________________。
(4)你估计“用稀硫酸溶解固体产物时,发现有爆鸣声和火花”的原因是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】探究金属钠与水或盐酸的反应记录如下。
实验序号 | 实验内容 | 实验现象 |
I | 0.23g钠与20mL蒸馏水 | 钠浮在水面上,熔成小球四处游动,发出嘶嘶响声,20s后钠块消失 |
II | 0.23g纳与20ml | 钠浮在水面上,熔成小球四处游动,发出嘶嘶响声,13s后钠块消失 |
(1)由实验现象可推断:金属钠与水成盐酸的反应,反应的共同特征是__________(写出两点)。
(2)研究实验I
①实验前水中![]() ______________。
______________。
②实验结束后所得溶液显碱性,原因可能是____________(填序号)。
a.生成的氢氧化钠属于碱
b.氢氧化钠在水中能电离出![]()
c.氢氧化钠抑制了水的电离,导致由水电离产生的![]()
d.钠与![]() 反应,促进水的电离,导致
反应,促进水的电离,导致![]()
(3)研究实验II
①实验前溶液pH=_____________
②实验结束后,溶液中离子浓度由大到小的顺序是_____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将标准状况下6.72L HCl溶于水配成100mL溶液,现用此盐酸与19.5g 锌粒反应制取氢气。试计算:(写出计算过程)
(1)此盐酸的物质的量浓度________________
(2)若要使锌完全反应,则所需盐酸的最小体积______________
(3)当锌粒完全反应时,制得标准状况下氢气的体积___________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、F六种物质有如下变化关系,E是淡黄色粉末,判断:

(1)写出A、B、C、D、E、F的化学式:
A._______;B.______;C.______;
D._______;E.______;F._______。
(2)写出有关反应的化学方程式(是离子反应的直接写出离子方程式)
E![]() B:______
B:______
C![]() F:______
F:______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA表示阿伏加德罗常数,下列说法正确的是( )
A.将1L0.1mol/L的FeCl3溶液制成胶体后,其中含有氢氧化铁胶粒数为0.1NA
B.常温常压下,23gNO2和N2O4的混合气体一定含有NA个氧原子
C.1L0.1mol/L Na2SO4溶液中含有0.4NA个氧原子
D.在标准状况下,22.4L的CCl4所含的分子数为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E五种烃分子中均含有8个氢原子,其中A、B常温下呈气态,C、D、E呈液态。请回答
(1)A是符合上述条件中相对分子质量最小的,则A的分子式为________;B属于链状单烯烃,且与HBr加成的产物只有一种,试写出B的结构简式________。
(2)C属于芳香烃,可用来制烈性炸药,试写出C制取烈性炸药的方程式_______________________________。
(3)已知E的结构简式为![]() 存在于煤焦油中,所有原子均处于同一平面内,则1mol E 最多能和___ mol的H2加成,写出E的所有一氯代物的结构简式_____________________________。
存在于煤焦油中,所有原子均处于同一平面内,则1mol E 最多能和___ mol的H2加成,写出E的所有一氯代物的结构简式_____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关胶体的说法中正确的是( )
A.夏日的傍晚常常看到万丈霞光穿云而过,美不胜收,这与胶体性质有关
B.浊液、胶体和溶液的最根本的区别是能否发生丁达尔效应
C.采用过滤法,可将![]() 胶体中的
胶体中的![]() 杂质除去
杂质除去
D.向三氯化铁溶液中滴入氢氧化钠溶液可制得![]() 胶体
胶体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2001年报道硼和镁形成的化合物刷新了金属化合物超导温度的最高记录.如图示意的是该化合物的晶体结构单元:镁原子间形成正六棱柱,且棱柱的上下底面各有一个镁原子,6个硼原子位于棱柱内,则该化合物的化学式可表示为( )
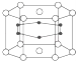
A. MgBB. MgB2C. Mg2BD. Mg3B2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com