
【题目】有浓度为0.1mol·L-1的盐酸、硫酸、醋酸三种溶液,试回答:
(1)三种溶液中c(H+)依次为a mol·L-1、b mol·L-1、cmol·L-1,大小顺序为 ______。
(2)等体积的以上三种酸分别与过量的NaOH溶液反应,生成的盐的物质的量依次为n1mol、n2mol、n3mol,它们的大小关系为 ______。
(3)中和等量NaOH溶液都生成正盐时,分别需上述三种酸的体积依次是V1L、V2L、V3 L,其大小关系为 ______。
(4)与等量锌反应时产生氢气![]() 的速率分别为v1、v2、v3,其大小关系为 ______。
的速率分别为v1、v2、v3,其大小关系为 ______。
【答案】(1)、b>a>c (2)、n1=n2=n3 (3)、V1=V3>V2或V1=V3=2V2 (4)、v2>v1>v3
【解析】
试题(1)氯化氢和硫酸是强电解质,盐酸是一元酸,硫酸是二元酸,醋酸是弱电解质且是一元酸,所以盐酸中氢离子浓度与酸的浓度相等,硫酸中氢离子浓度是硫酸的浓度的2倍,醋酸中氢离子浓度小于醋酸的浓度,所以氢离子浓度大小顺序为a=![]() b>c;(2)根据阴离子守恒知,盐的物质的量与酸的物质的量相等,所以生成的盐的物质的量大小关系为n1 =n2=n3; (3)中和一定量NaOH溶液生成正盐时,酸的浓度相等,如果是一元酸,所用酸的体积相等,如果是二元酸,酸的体积是一元酸的一半,所以三种酸的体积大小关系是V1=2V2=V3;(4)与锌反应时产生氢(气)的速率与氢离子浓度成正比,氢离子浓度越大,反应速率越大,三种酸中硫酸中氢离子浓度为0.2mol/L,盐酸中氢离子浓度为0.1mol/L,醋酸中氢离子浓度小于0.1mol/L,所以反应速率大小关系为v2>v1>v3。
b>c;(2)根据阴离子守恒知,盐的物质的量与酸的物质的量相等,所以生成的盐的物质的量大小关系为n1 =n2=n3; (3)中和一定量NaOH溶液生成正盐时,酸的浓度相等,如果是一元酸,所用酸的体积相等,如果是二元酸,酸的体积是一元酸的一半,所以三种酸的体积大小关系是V1=2V2=V3;(4)与锌反应时产生氢(气)的速率与氢离子浓度成正比,氢离子浓度越大,反应速率越大,三种酸中硫酸中氢离子浓度为0.2mol/L,盐酸中氢离子浓度为0.1mol/L,醋酸中氢离子浓度小于0.1mol/L,所以反应速率大小关系为v2>v1>v3。


 阳光课堂同步练习系列答案
阳光课堂同步练习系列答案科目:高中化学 来源: 题型:
【题目】下列有关化学键类型的叙述正确的是( )
A.全部由非金属构成的化合物中肯定不存在离子键
B.所有物质中都存在化学键
C.已知乙炔的结构式为H—C≡C—H,则乙炔中存在2个σ键(C—H)和3个π键(C≡C)
D.乙烷分子中只存在σ键,不存在π键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在恒容密闭容器中,由CO合成甲醇:CO(g)+2H2(g)![]() CH3OH(g),在其他条件不变的情况下,研究温度对反应的影响,实验结果如图所示,下列说法正确的是
CH3OH(g),在其他条件不变的情况下,研究温度对反应的影响,实验结果如图所示,下列说法正确的是
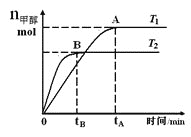
A. 平衡常数K=![]()
B. 该反应在T1时的平衡常数比T2时的小
C. CO合成甲醇的反应为吸热反应
D. 处于A点的反应体系从T1变到T2,达到平衡时![]() 增大
增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在两个恒容的密闭容器中,进行下列两个可逆反应:
甲:C(s)+H2O(g)![]() CO(g)+H2(g)
CO(g)+H2(g)
乙:CO(g)+H2O(g)![]() CO2(g)+H2(g)
CO2(g)+H2(g)
下列状态中能表明甲、乙容器内的反应都达到平衡状态的是( )
A. 混合气体密度不变B. 反应体系中温度保持不变
C. 各气体组成浓度相等D. 恒温时,气体压强不再改变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种熔融碳酸盐燃料电池原理示意如图。下列有关该电池的说法正确的是( )
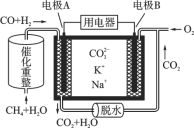
A. 反应CH4+H2O![]() 3H2+CO,每消耗1 mol CH4 转移2 mol 电子
3H2+CO,每消耗1 mol CH4 转移2 mol 电子
B. 电极A上H2参与的电极反应为:H2+2OH--2e-===2H2O
C. 电池工作时,CO32-向电极B移动
D. 电极B上发生的电极反应为:O2+2CO2+4e-===2CO32-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,将两种气体M和N通入容积为VL的密闭容器中进行反应,M和N的物质的量与时间的关系如图所示,下列说法正确的是( )

A. 0~t2内用M表示的平均反应速率是2/t2(mol·L-1·min-1)
B. t1~t2内容器内的压强逐渐减小
C. 该反应的方程式为N![]() 2M
2M
D. t2与t3时刻的混合气体的平均相对分子质量相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜的相关化合物在生产生活中具有重要的作用。回答下列问题:
(1)铜元素在周期表中的位置是______,基态铜原子中,核外电子占据最高能层的符号是______,占据该最高能层的电子数为__________。
(2)在一定条件下,金属相互化合形成的化合物称为金属互化物,如Cu9Al4、Cu5Zn8等。某金属互化物具有自范性,原子在三维空间里呈周期性有序排列,该金属互化物属于__________(填“晶体”或“非晶体”)。
(3)铜能与类卤素[(SCN)2]反应生成Cu(SCN)2,1mol(SCN)2分子中含有σ键的数目为_____________。硫氰酸(H-S-C≡N)和异硫氰酸(H-N=C=S),这两种酸中沸点较高的是异硫氰酸(H-N=C=S)。理论上前者沸点低于后者,其原因是____________________________。
(4)铜晶体中铜原子的堆积方式为面心立方堆积,每个铜原子周围距离最近的铜原子个数为________。
(5)铜与金形成的金属互化物的晶胞结构如图所示,其晶胞边长为a nm,该金属互化物的密度为____![]() 用含a、NA的代数式表示)gcm-3。
用含a、NA的代数式表示)gcm-3。
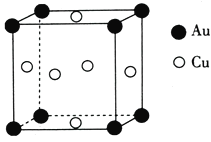
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列热化学方程式正确的是
A.甲烷的燃烧热为890.3 kJ·mol-1,则甲烷燃烧的热化学方程式可表示为
CH4(g)+2O2(g)===CO2(g)+2H2O(g) ΔH=-890.3 kJ·mol-1
B.500 ℃、30 MPa下,将0.5 mol N2和1.5 mol H2置于密闭容器中充分反应生成NH3(g),放热19.3 kJ,其热化学方程式为N2(g)+3H2(g)![]() 2NH3(g) ΔH=-38.6 kJ·mol-1
2NH3(g) ΔH=-38.6 kJ·mol-1
C.已知在101 kPa下,1 g H2燃烧生成水蒸气放出121 kJ热量,其热化学方程式为
H2(g)+![]() O2(g)===H2O(g) ΔH=-242 kJ·mol-1
O2(g)===H2O(g) ΔH=-242 kJ·mol-1
D.25 ℃,101 kPa时,强酸与强碱的稀溶液发生中和反应的中和热为57.3 kJ·mol-1,表示稀硫酸与氢氧化钾溶液反应的中和热的热化学方程式为H2SO4(aq)+2KOH(aq)=K2SO4(aq)+2H2O(l) ΔH=-114.6 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中国女药学家屠呦呦因研制新型抗疟青蒿素和双氢青蒿素成果而获得2015年诺贝尔生理学或医学奖。青蒿素和双氧青蒿素结构如图所示。下列关于青蒿素和双氢青蒿素的说法正确的是( )
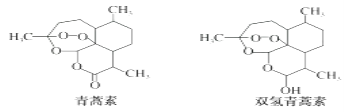
A. 青蒿素的分子式为C15H22O5B. 青蒿素和双氢青蒿素是同分异构体
C. 青蒿素和双氢青蒿素都能发生酯化反应 D. 双氢青蒿素在水中的溶解性小于青蒿素
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com