
【题目】下列热化学方程式正确的是
A.甲烷的燃烧热为890.3 kJ·mol-1,则甲烷燃烧的热化学方程式可表示为
CH4(g)+2O2(g)===CO2(g)+2H2O(g) ΔH=-890.3 kJ·mol-1
B.500 ℃、30 MPa下,将0.5 mol N2和1.5 mol H2置于密闭容器中充分反应生成NH3(g),放热19.3 kJ,其热化学方程式为N2(g)+3H2(g)![]() 2NH3(g) ΔH=-38.6 kJ·mol-1
2NH3(g) ΔH=-38.6 kJ·mol-1
C.已知在101 kPa下,1 g H2燃烧生成水蒸气放出121 kJ热量,其热化学方程式为
H2(g)+![]() O2(g)===H2O(g) ΔH=-242 kJ·mol-1
O2(g)===H2O(g) ΔH=-242 kJ·mol-1
D.25 ℃,101 kPa时,强酸与强碱的稀溶液发生中和反应的中和热为57.3 kJ·mol-1,表示稀硫酸与氢氧化钾溶液反应的中和热的热化学方程式为H2SO4(aq)+2KOH(aq)=K2SO4(aq)+2H2O(l) ΔH=-114.6 kJ·mol-1
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】可逆反应:2SO2+O2![]() 2SO3达到平衡状态时,保持恒温恒容向容器中加入一定量的O2。下列说法正确的是(K为平衡常数,Qc为浓度商)( )
2SO3达到平衡状态时,保持恒温恒容向容器中加入一定量的O2。下列说法正确的是(K为平衡常数,Qc为浓度商)( )
A. Qc不变,K变大,O2转化率增大 B. Qc不变,K变大,SO2转化率减小
C. Qc变小,K不变,O2转化率减小 D. Qc增大,K不变,SO2转化率增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有浓度为0.1mol·L-1的盐酸、硫酸、醋酸三种溶液,试回答:
(1)三种溶液中c(H+)依次为a mol·L-1、b mol·L-1、cmol·L-1,大小顺序为 ______。
(2)等体积的以上三种酸分别与过量的NaOH溶液反应,生成的盐的物质的量依次为n1mol、n2mol、n3mol,它们的大小关系为 ______。
(3)中和等量NaOH溶液都生成正盐时,分别需上述三种酸的体积依次是V1L、V2L、V3 L,其大小关系为 ______。
(4)与等量锌反应时产生氢气![]() 的速率分别为v1、v2、v3,其大小关系为 ______。
的速率分别为v1、v2、v3,其大小关系为 ______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列电离方程式中,正确的是( )
A.Ca(OH)2=Ca2++2(OH)-B.FeCl2=Fe2++3Cl-
C.H2SO4=H2++SO42-D.Al2(SO4)3=2Al3++3SO42-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在某体系内有反应物和生成物5种物质:H2S、S、FeCl3、FeCl2、HCl。已知FeCl3为反应物,则另一反应物是( )
A.H2SB.FeCl2C.SD.HCl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的一组是( )
A. H2、D2和T2互为同位素
B. 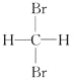 和
和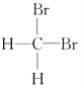 互为同分异构体
互为同分异构体
C. 正丁烷和异丁烷互为同系物
D. (CH3)2CHC2H5和CH3CH2CH(CH3)2属于同种物质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电池在我们的生活中有着重要的应用,请回答下列问题:
(1)为了验证Fe2+与Cu2+氧化性强弱,下列装置能达到实验目的的是______(填序号),写出正极的电极反应式_______。若构建原电池时两个电极的质量相等,当导线中通过0.05mol电子时,两个电极的质量差为________。
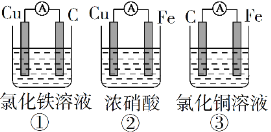
(2)将CH4设计成燃料电池,其利用率更高,装置如图所示(A、B为多孔碳棒)。
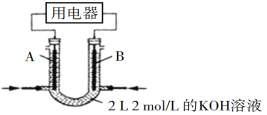
实验测得OH定问移向B电极,则_____(填“A”或“B”)处电极入口通甲烷,其电极反应式为___________。当消耗甲院的体积为33.6 L(标准状况下)时,假设电池的能量转化率为80%,则导线中转移电子的物质的量为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】联氨(又称肼,N2H4,无色液体)是一种应用广泛的化工原料,可用作火箭燃料.回答下列问题:
(1)联氨分子的电子式为___________, 其中氮的化合价为___________.
(2)实验室中可用次氯酸钠溶液与氨反应制备联氨,反应的化学方程式为____________.
(3)①2O2(g)+N2(g)═N2O4(l) △H1
②N2(g)+2H2(g)═N2H4(l) △H2
③O2(g)+2H2(g)═2H2O(g) △H3
④2N2H4(l)+N2O4(l)═3N2(g)+4H2O(g) △H4=﹣1048.9kJmol﹣1
上述反应热效应之间的关系式为△H4=______________, 联氨和N2O4可作为火箭推进剂的主要原因为______________________.
(4)联氨为二元弱碱,在水中的电离方式与氨相似.联氨第一步电离反应的平衡常数值为_____ (已知:N2H4+H+N2H5+的K=8.7×107;Kw=1.0×10﹣14).联氨与硫酸形成的酸式盐的化学式为_______________.
(5)联氨是一种常用的还原剂.向装有少量AgBr的试管中加入联氨溶液,观察到的现象是_______________. 联氨可用于处理高压锅炉水中的氧,防止锅炉被腐蚀.理论上1kg的联氨可除去水中溶解的O2__________kg;与使用Na2SO3处理水中溶解的O2相比,联氨的优点是________________________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有三种不同堆积方式的金属晶体的晶胞如图所示,有关说法正确的是
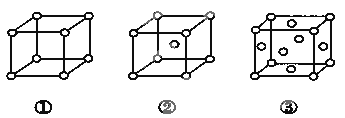
A. ①、②、③依次为简单立方堆积、六方最密堆积、体心立方堆积
B. 每个晶胞含有的原子数分别为:①1个,②2个,③6个
C. 晶胞中原子的配位数分别为:①6, ②8 ,③12
D. 空间利用率的大小关系为:①>②>③
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com