
【题目】下列有关化学键类型的叙述正确的是( )
A.全部由非金属构成的化合物中肯定不存在离子键
B.所有物质中都存在化学键
C.已知乙炔的结构式为H—C≡C—H,则乙炔中存在2个σ键(C—H)和3个π键(C≡C)
D.乙烷分子中只存在σ键,不存在π键
科目:高中化学 来源: 题型:
【题目】反应Fe(s) +CO2 (g)![]() FeO(s)+CO(g),700℃时平衡常数为1.47,900℃时平衡常数为2.15。下列说法正确的是
FeO(s)+CO(g),700℃时平衡常数为1.47,900℃时平衡常数为2.15。下列说法正确的是
A. 升高温度该反应的正反应速率增大,逆反应速率减小
B. 该反应的化学平衡常数表达式为K=![]()
C. 绝热容器中进行该反应,温度不再变化,则达到化学平衡状态
D. 该反应的正反应是放热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】依据事实,按要求填空:
(1)在25℃、101kPa下,1mol乙醇燃烧生成CO2和液态水时放热1269.6kJ.则表示乙醇燃烧热的热化学方程式为______.
(2)已知拆开1mol H﹣H键,1molN﹣H键,1molN≡N键分别需要的能量是436kJ、391kJ、946kJ,则N2(g)与H2(g)反应生成NH3(g)的热化学方程式为______.
(3)已知:2SO2(g)+O2(g)═2SO3(g)△H=﹣196.6kJmol﹣1
2NO(g)+O2(g)═2NO2(g)△H=﹣113.0kJmol﹣1
则反应NO2(g)+SO2(g)═SO3(g)+NO(g)的△H=______kJmol﹣1.
(4)由氢气和氧气反应生成1mol水蒸气放热241.8kJ,写出该反应的热化学方程式:______.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示是Zn和Cu形成的原电池,某实验兴趣小组做完实验后,在读书卡上的记录如下,则卡片上的描述合理的是
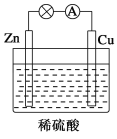

A. ①②③ B. ①②④ C. ②④ D. ③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)已知拆开1 mol H—H键、1 mol N—H键、1 mol N≡N键需要的能量分别是436 kJ、391 kJ、946 kJ,则N2与H2反应生成NH3的热化学方程式为_________________。
(2)已知化学反应A2(g)+B2(g)===2AB(g)的能量变化如图所示,回答下列问题:
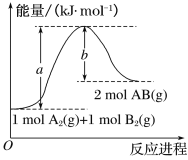
①该反应的ΔH_______0(填 “大于”“小于”或“等于”);
②反应物的总键能为______________;
③写出该反应的热化学方程式________________________________。
(3)联氨(又称肼,N2H4,无色液体)是一种应用广泛的化工原料,可用作火箭燃料,回答下列问题:
①2O2(g)+N2(g)=N2O4(l) ΔH1
②N2(g)+2H2(g)=N2H4(l) ΔH2
③O2(g)+2H2(g)=2H2O(g) ΔH3
④2N2H4(l) + N2O4(l)= 3N2(g)+ 4H2O(g) ΔH 4=-1048.9kJ/mol
写出联氨的结构式_______________,上述反应热效应之间的关系式为ΔH4=__________,联氨和N2O4可作为火箭推进剂的主要原因为_______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
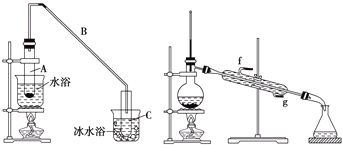
【题目】化学小组采用类似制乙酸乙酯的装置(如下图),用环己醇制备环己烯。
已知: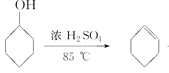 +H2O
+H2O
密度 | 熔点 | 沸点 | 溶解性 | |
环己醇 |
| 25 | 161 | 能溶于水 |
环己烯 |
|
| 83 | 难溶于水 |
(1)制备粗品
将12.5mL环己醇加入试管A中,再加入1mL浓硫酸,摇匀后放入碎瓷片(防止暴沸),缓慢加热至反应完全,在试管C内得到环己烯粗品。
导管B除了导气外还具有的作用是______。
②试管C置于冰水浴中的目的是______。
(2)制备精品
①环己烯粗品中含有环己醇和少量酸性杂质等![]() 加入饱和食盐水,振荡、静置、分层,环己烯在______层(填“上”或“下”),分液后用______(填入编号)洗涤。
加入饱和食盐水,振荡、静置、分层,环己烯在______层(填“上”或“下”),分液后用______(填入编号)洗涤。
A.KMnO4溶液![]() 稀H2SO4 C.Na2CO3溶液
稀H2SO4 C.Na2CO3溶液
②再将环己烯按上图装置蒸馏,冷却水从______口进入![]() 填“g”或“f”),蒸馏时要加入生石灰,其目的是______。
填“g”或“f”),蒸馏时要加入生石灰,其目的是______。
③收集产品时,控制的温应在______左右,实验制得的环己烯精品质量低于理论产量,可能的原因是_____。
A.蒸馏时从![]() 开始收集产品
开始收集产品
B.环己醇实际用量多了
C.制备粗品时环己醇随产品一起蒸出
(3)以下区分环己烯精品和粗品的方法,合理的是______。
A.分别加入酸性高锰酸钾溶液
B.分别加入用金属钠
C.分别测定沸点
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应:2SO2+O2![]() 2SO3达到平衡状态时,保持恒温恒容向容器中加入一定量的O2。下列说法正确的是(K为平衡常数,Qc为浓度商)( )
2SO3达到平衡状态时,保持恒温恒容向容器中加入一定量的O2。下列说法正确的是(K为平衡常数,Qc为浓度商)( )
A. Qc不变,K变大,O2转化率增大 B. Qc不变,K变大,SO2转化率减小
C. Qc变小,K不变,O2转化率减小 D. Qc增大,K不变,SO2转化率增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有浓度为0.1mol·L-1的盐酸、硫酸、醋酸三种溶液,试回答:
(1)三种溶液中c(H+)依次为a mol·L-1、b mol·L-1、cmol·L-1,大小顺序为 ______。
(2)等体积的以上三种酸分别与过量的NaOH溶液反应,生成的盐的物质的量依次为n1mol、n2mol、n3mol,它们的大小关系为 ______。
(3)中和等量NaOH溶液都生成正盐时,分别需上述三种酸的体积依次是V1L、V2L、V3 L,其大小关系为 ______。
(4)与等量锌反应时产生氢气![]() 的速率分别为v1、v2、v3,其大小关系为 ______。
的速率分别为v1、v2、v3,其大小关系为 ______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com