
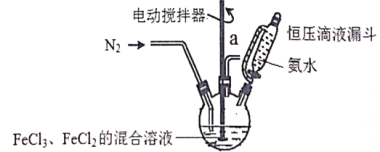
【题目】超顺磁性的Fe3O4粒子(粒子平均直径为25nm)在医疗上有重要作用,实验室制备方法如下:在有N2保护和剧烈搅拌条件下,向FeCl3、FeCl2混合溶液中滴加氨水,可得到黑色的Fe3O4。实验装置如图:
请回答下列问题:
(1)恒压滴液漏斗的优点是______________________。
(2)充N2的目的是___________,反应温度应控制在50℃,加热方法为___________。
(3)制备超顺磁性Fe3O4粒子反应原理的离子方程式为______________________。
(4)充分反应后,将三颈烧瓶中的混合物通过离心分离,然后水洗,最后用无水乙醇洗涤,用无水乙醇洗涤的优点是___________;为了验证得到的固体是超顺磁性的Fe3O4粒子,实验操作:_______________。为了检验超顺磁性粒子中含有+2价的铁,需要的化学试剂为___________(填代号)。
A.KSCN溶液 B.HCl溶液 C.H2O2溶液 D.K3[Fe(CN)6]溶液
(5)实验制得的超顺磁性的Fe3O4粒子中含有少量的Fe(OH)3,为测得Fe3O4的含量,称取mg试样,放在小烧杯中用足量稀硫酸溶解后定容于100mL容量瓶中,准确量取其中的20.00mL溶液置于锥形瓶中,然后用cmol/L的KMnO4溶液进行滴定,当______________________停止滴定,然后重复二次滴定,平均消耗KMnO4溶液ⅴmL,该样品的纯度为___________。(已知MnO4-+5Fe2++8H+=Mn2++5Fe3++4H2O)
【答案】能保证氨水顺利地滴入三颈烧瓶中 防止FeCl3、FeCl2混合溶液中的Fe2+被氧化 水浴加热 Fe2++2Fe3++8NH3·H2O=Fe3O4+8NH4++4H2O 能得到干燥的超顺磁性的Fe3O4粒子 将得到的固体分散在水中,做丁达尔效应实验 BD 滴入最后一滴标准溶液,溶液变成紫红色,且30秒颜色无变化 ![]()
【解析】
(1)恒压滴液漏斗可以使液体物质氨水的液面上下气体压强一致,氨水在重力作用下就可以顺利滴下;
(2)反应装置内的空间有空气,空气能够将溶液中的Fe2+氧化为Fe3+,通入N2就可以防止三颈烧瓶内FeCl3、FeCl2混合溶液中的Fe2+被氧化;由于反应温度应控制在50℃,低于100℃,所以采用的加热方法为水浴加热;
(3)在有N2保护和剧烈搅拌条件下,向FeCl3、FeCl2混合溶液中滴加氨水,可得到黑色的Fe3O4,同时产生NH4Cl,根据原子守恒和电荷守恒,可得制备超顺磁性Fe3O4粒子反应原理的离子方程式为Fe2++2Fe3++8NH3·H2O=Fe3O4+8NH4++4H2O;
(4)充分反应后,将三颈烧瓶中的混合物通过离心分离,然后水洗,最后用无水乙醇洗涤,由于无水乙醇容易挥发,挥发时吸收大量的热,所以若用无水乙醇洗涤的优点是能快速得到干燥的超顺磁性的Fe3O4粒子;超顺磁性的Fe3O4粒子的粒子平均直径为25nm,具有胶体颗粒大小,为了验证得到的固体是超顺磁性的Fe3O4粒子,可将其分散在水中,做丁达尔效应实验,若产生一条光亮的通路,证明分散系为胶体。为了检验超顺磁性粒子中含有+2价的铁,用非氧化性的酸HCl溶解,向溶液中加入K3[Fe(CN)6]溶液,产生蓝色沉淀,就证明其中含有Fe2+,故需要的试剂合理选项是BD;
(5) Fe3O4与硫酸反应产生的离子中含有Fe2+、Fe3+,而Fe(OH)3反应只产生Fe3+,所以用KMnO4酸性溶液滴定时,当Fe2+反应完全,再滴入时,溶液就会由无色变为高锰酸钾溶液的紫色,故滴定终点为:滴入最后一滴标准溶液,溶液变成紫红色,且30秒颜色无变化。根据Fe3O4+8H+= Fe2++2Fe3++4H2O,MnO4-+5Fe2++8H+=Mn2++5Fe3++4H2O可得关系式:5Fe3O4—5Fe2+—MnO4-;n(KMnO4)=cmol/L×V×10-3L×![]() =5cV×10-3mol,所以n(Fe3O4)= 5n(KMnO4)=25cV×10-3mol,故mg试样的纯度为:
=5cV×10-3mol,所以n(Fe3O4)= 5n(KMnO4)=25cV×10-3mol,故mg试样的纯度为:![]() 。
。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】美国C.Marchetin博士对世界一次能源替代趋势作了如图所示预测。回答下列问题:

(1)图中属于化石能源的有煤、石油和_____。
(2)目前采用铀核裂变方式获取核能,![]() 中含有的中子数为____;
中含有的中子数为____;![]() 与
与![]() 的关系是_____。
的关系是_____。
(3)太阳能是一种新能源,制造太阳能电池的材料有Si、Ga、As等。它们能用于制造太阳能电池是利用其____性质;Ga与As均是第四周期的主族元素,Ga与Al同主族,As与N同主族,则元素As、Ga的最高价氧化物对应水化物酸性较强的是____(填化学式)。
(4)近年来我国在南海成功试开采可燃冰,可燃冰释放的气体主要有CH4、少量乙烷、丙烷及丁烷等。丙烷完全燃烧的化学方程式为____;异丁烷的一氯取代物有___种。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙酸乙酯广泛用于药物、染料、香料等工业,其制备原理为:![]()
甲、乙两同学分别设计了如下装置来制备乙酸乙酯。

请回答下列问题:
(1)下列说法不正确的是________。
A.加入试剂的顺序依次为乙醇、浓硫酸、乙酸
B.饱和碳酸钠的作用是中和乙酸、溶解乙醇、促进乙酸乙酯在水中的溶解
C.浓硫酸在反应中作催化剂和吸水剂,加入的量越多对反应越有利
D.反应结束后,将试管中收集到的产品倒入分液漏斗中,振荡、静置,待液体分层后即可从上口倒出上层的乙酸乙酯
(2)乙装置优于甲装置的理由是________。(至少说出两点)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期W、X、Y、Z、Q五种元素的原子序数依次递增,W和Z位于同一主族。已知W的氢化物可与Q单质在光照条件下反应生成多种化合物,且Y、Q形成一种共价化合物,X的最高价氧化物对应的水化物可与Z单质反应产生常见的还原性气体单质E。下列说法不正确的是
A. X、Z的最高价氧化物相互化合,生成的产物可用作防火剂
B. Y、Q形成的化合物是强电解质
C. 电解X、Q元素组成的化合物的饱和溶液常被用于实验室制备E单质
D. W、X、Q三种元素都能形成多种氧化物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇被称为2l世纪的新型燃料,工业上可以用CH4和H2O为原料来制备甲醇.
(1)将1.0mol CH4和2.0mol H2O(g)通入容积为10L的反应室,在一定条件下发生反应
Ⅰ:CH4(g)+H2O(g)![]() CO(g)+3H2(g),CH4的转化率与温度、压强的关系如图甲:
CO(g)+3H2(g),CH4的转化率与温度、压强的关系如图甲:

已知100℃,压强为P1时,达到平衡所需的时间为5min,
①则用 H2 表示的平均反应速率为______.
②在其它条件不变的情况下升高温度,化学平衡常数将____(填“增大”“减小”或“不变”).
③图中的P1____P2(填“<”、“>”或“=”),在100℃,压强为P1时平衡常数为_______.
④保持反应体系100℃,压强为P1,5min后再向容器中冲入H2O、 H2各0.5mol,化学平衡将向___移动(填“向左”“向右或“不”).
(2)在一定条件下,将a mol CO与 3a mol H2的混合气体在催化剂作用下能自发发生反应
Ⅱ:CO(g)+2H2(g)![]() CH3OH(g)
CH3OH(g)
①该反应的△H___0,△S___0(填“<”、“>”或“=”).
②若容器容积不变,下列措施可以提高CO转化率的是____.
A.升高温度
B.将CH3OH(g)从体系中分离出来
C.充入He,使体系总压强增大
D.再充入1mol CO和3mol H2.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)请填写下表:
物质 | 摩尔质量 | 物质的量 | 质量 | 分子或离子数目 |
SO2 | ________ | 2 mol | ________ | ________ |
SO42- | ________ | ________ | ________ | 6.02×1022 |
O2 | ________ | ________ | 8.0 g | ________ |
(2)O2和O3是氧元素的两种单质。根据分子式回答。等质量的O2和O3所含分子数之比为____,原子个数比为____。
(3)摩尔质量是指单位物质的量的物质所含有的质量。
①已知NH3的相对分子质量为17,则NH3的摩尔质量为____。
②1.28 g某气体含有的分子数目为1.204×1022,则该气体的摩尔质量为____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】阿塞那平用于治疗精神分裂症,可通过以下方法合成部分反应条件略去)
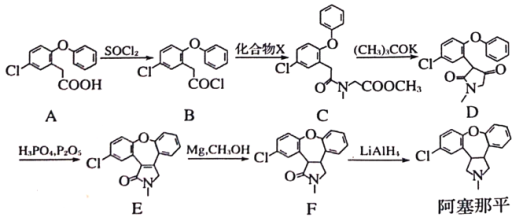
(1)阿塞那平中的含氧官能团名称为___________,由F→阿塞那平的反应类型为___________。物质A的分子式为___________。
(2)A生成B的过程中有SO2产生,写出A→B反应方程式______________________。
(3)化合物X的分子式为C4H9NO2,则X的结构简式为______________________。
(4)由D生成E的过程中先发生加成反应,后发生消去反应,加成反应后生成的中间体的结构简式为___________。
(5)写出同时满足下列条件的B的一种同分异构体的结构简式:__________________。
I属于芳香化合物,分子中含有5种不同化学环境的氢;
Ⅱ能发生银镜反应和水解反应,水解产物能与FeCl3溶液发生显色反应。
(6)参照上述合成流程,写出以CH3NH2和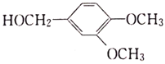 为原料制备
为原料制备 的合成流程(无机试剂任用)______________________。
的合成流程(无机试剂任用)______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了研究Mg(OH)2溶于铵盐溶液的原因,进行如下实验:
①向2mL 0.2mol/LMgCl2溶液中滴加1mol/LNaOH溶液至不再产生沉淀,将浊液分为2等份。
②向一份中逐滴加入4mol/L NH4Cl溶液,另一份中逐滴加入4mol/L CH3COONH4溶液(pH≈7),边滴加边测定其中沉淀的量,沉淀的量与铵盐溶液的体积的关系如图。
③将①中的NaOH溶液用氨水替换,重复上述实验。
下列说法不正确的是
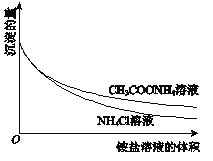
A. Mg(OH)2浊液中存在:Mg(OH)2(s)![]() Mg2+(aq)+2OH﹣(aq)
Mg2+(aq)+2OH﹣(aq)
B. ②中两组实验中均存在反应:Mg(OH)2+2NH4+=Mg2++2NH3H2O
C. H+可能参与了NH4Cl溶液溶解Mg(OH)2的过程
D. ③中获得的图象与②相同
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com