
����Ŀ���״�����Ϊ2l���͵�����ȼ�ϣ���ҵ�Ͽ�����CH4��H2OΪԭ�����Ʊ��״���
��1����1.0mol CH4��2.0mol H2O��g��ͨ���ݻ�Ϊ10L�ķ�Ӧ�ң���һ�������·�����Ӧ
��CH4��g��+H2O��g��![]() CO��g��+3H2��g����CH4��ת�������¶ȡ�ѹǿ�Ĺ�ϵ��ͼ����
CO��g��+3H2��g����CH4��ת�������¶ȡ�ѹǿ�Ĺ�ϵ��ͼ����

��֪100��,ѹǿΪP1ʱ,�ﵽƽ�������ʱ��Ϊ5min��
������ H2 ��ʾ��ƽ����Ӧ����Ϊ______��
���������������������������¶ȣ���ѧƽ�ⳣ����____����������������С����������������
��ͼ�е�P1____P2����������������������=��������100��,ѹǿΪP1ʱƽ�ⳣ��Ϊ_______��
�ܱ��ַ�Ӧ��ϵ100��,ѹǿΪP1��5min�����������г���H2O�� H2��0.5mol����ѧƽ�⽫��___�ƶ������������������һ�����������
��2����һ�������£���a mol CO�� 3a mol H2�Ļ�������ڴ������������Է�������Ӧ
��CO��g��+2H2��g��![]() CH3OH��g��
CH3OH��g��
�ٸ÷�Ӧ����H___0����S___0����������������������=������
���������ݻ����䣬���д�ʩ�������COת���ʵ���____��
A�������¶�
B����CH3OH��g������ϵ�з������
C������He��ʹ��ϵ��ѹǿ����
D���ٳ���1mol CO��3mol H2��
���𰸡�0.030molL-1min-1 ���� �� 2.25��10-2 ���� �� �� BD
��������
(1)������ͼ֪��ƽ��ʱ�����ת����,���c(CH4),����v=c/t ����v(CH4),��������֮�ȵ��ڻ�ѧ������֮�ȼ���v(H2)��
��ת�������¶ȡ�ѹǿͼ������������,Ӧ����һ�������
�����ݶ�һ���ԭ��,���¶�ͬ,�ٱȽ�ѹǿ,������ֱx��ĸ�����,�Ƚ�ƽ��ʱ�����ת����,�ɴ��ж�;ƽ�ⳣ��k=c(CO)c2(H2)/c(CH4)c(H2O)�������ƽ��ʱ����ֵ�Ũ��,����ƽ�ⳣ������ʽ������
�����ַ�Ӧ��ϵΪ100��,5min�����������г���H2O��H2��0.5mol,����Ũ������ƽ�ⳣ������Դ�С���ж���
(2)����������ڴ������������Է���Ӧ���ɼ״�,��˵������Ӧ�Ƿ��ȷ�Ӧ,����Ӧ���������ʵ�����С�ķ�Ӧ��
�������ݻ�����,���Ӽ״�����,ƽ��������Ӧ�ƶ�,�������������ƽ���Ӱ�������
(1)����100��ƽ��CH4��ת����Ϊ0.5����֪��,����CH4Ϊ1��0.5=0.5mol��ƽ��ʱ�����Ũ�ȱ仯��Ϊ:0.5/10=0.05mol/L,���ݼ����������ļ�������ϵ,��: v(H2)=3 v(CH4)=3��0.05/5=0.030molL-1min-1����ˣ�������ȷ����: 0.030molL-1min-1��
����ѹǿΪp1ʱ,�����¶�,�����ת�������,ƽ���������ƶ�,��������Ϊ���ȷ�Ӧ,���������¶�ƽ�ⳣ������������������������������
��ͨ��ͼ������֪�����¶���ͬʱ,p2��p1ʱ,�����ת�������,ƽ���������ƶ�,����Ϊ����ϵ������ķ�Ӧ,���ݼ�Сѹǿƽ����ϵ������ķ����ƶ��ɵó�p1< p2����ˣ�������ȷ����: ����
�� CH4��g��+H2O��g��![]() CO��g��+3H2��g��
CO��g��+3H2��g��
��ʼŨ��: 0.1 0.2 0 0
�仯Ũ��: 0.05 0.05 0.05 0.15
ƽ��Ũ��: 0.05 0.15 0.05 0.15
100��ʱƽ�ⳣ��=0.05����0.15��3/0.05��0.15= 2.25��10-2��5min�����������г���H2O�� H2��0.5mol��������Ũ��Ϊ��c(H2O)=0.15+0.05=0.2mol/L��c(H2)= =0.15+0.05=0.2mol/L��QC=0.23��0.05/0.05��0.2=0.04> 2.25��10-2������Ӧ����С���淴Ӧ������ƽ�������ƶ����������������������2.25��10-2������
(2)����������ڴ������������Է���Ӧ���ɼ״�,��˵������Ӧ�Ƿ��ȷ�Ӧ,������H<0 ������Ӧ���������ʵ�����С�ķ�Ӧ,��������ʵ���Խ��,����Խ��,���ԡ�S<0����ˣ�������ȷ����:<�� <��
��A.�÷�ӦΪ���ȷ�Ӧ,�����¶�,ƽ�������ȷ����ƶ�,�����淴Ӧ�����ƶ�, COת���ʽ�������A������
B.�� CH3OH��g������ϵ�з���,�����Ũ�Ƚ�����ƽ��������Ӧ�ƶ���COת������������B��ȷ��
C.����He��ʹ��ϵ��ѹǿ�����������ݻ���������Ӧ���������Ũ�Ȳ�����ƽ�ⲻ�ƶ�, COת���ʲ�������C������
D.�ٳ���1mol CO��3mol H2���ɵ�ЧΪѹǿ����,ƽ���������С�ķ����ƶ�,��������Ӧ�����ƶ���COת������������D��ȷ��
��ˣ�������ȷ����:BD��


 ����˼ά����ѵ����ʱ��ѧ��ϵ�д�
����˼ά����ѵ����ʱ��ѧ��ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪2H2(g)��O2(g)=2H2O(l) ��H����569.6kJ/mol,2H2O(g)=2H2(g)��O2(g) ��H����482.1 kJ/mol������1gҺ̬H2O������ʱ���յ������� (����)
A. 2.43 kJ B. 4.86 kJ C. 43.8 kJ D. 87.5 kJ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵������ȷ���ǣ� ��
A.���ײ��������Ҵ�B.С�մ������θ�����֢
C.�ɱ��������˹�����D.�辧������뵼�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����и�ͼ������ȷ��ӳ���Ӧ�����и����仯��ϵ���� ( )
A.  ��һ�������ĸ�����ؼ���������
��һ�������ĸ�����ؼ���������
B.  ��һ��������ʯ��ʯ�м��������ϡ����
��һ��������ʯ��ʯ�м��������ϡ����
C.  ��һ���¶��µı�������������Һ�в��ϼ��������ƹ���
��һ���¶��µı�������������Һ�в��ϼ��������ƹ���
D.  �ֱ�����������������м�����������������ͬ��ϡ����������
�ֱ�����������������м�����������������ͬ��ϡ����������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ŀǰ��ˮҺ���ɲ���˫��Ĥ��Һ������ͬʱ��ø���Ʒ����ģ���ԭ����ͼ��ʾ������˫��Ĥ(BP)������������Ĥ����ֱ����������£�������Ĥ���ϲ���H2O�����H+��OH-,��ΪH+��OH-����Դ��M��NΪ���ӽ���Ĥ������˵����ȷ������ ��

A. X�缫Ϊ���ص��������õ缫��ӦʽΪ��2H+-2e-=H2��
B. ����������Դ������X�缫��Y�缫����Դ����
C. ��·��ÿת��1mol���ӣ�X��Y�������õ���״����16.8L������
D. MΪ�����ӽ���Ĥ��A�һ�ø���ƷNaOH;��ȥ��B��˫��Ĥ��B�Ҳ��ﲻ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����˳���Ե�Fe3O4����(����ƽ��ֱ��Ϊ25nm)��ҽ��������Ҫ���ã�ʵ�����Ʊ��������£�����N2�����;��ҽ��������£���FeCl3��FeCl2�����Һ�еμӰ�ˮ���ɵõ���ɫ��Fe3O4��ʵ��װ����ͼ��
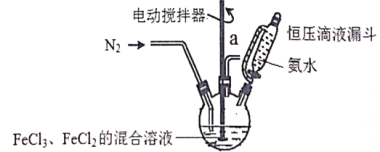
��ش��������⣺
(1)��ѹ��Һ©�����ŵ���______________________��
(2)��N2��Ŀ����___________����Ӧ�¶�Ӧ������50�棬���ȷ���Ϊ___________��
(3)�Ʊ���˳����Fe3O4���ӷ�Ӧԭ�������ӷ���ʽΪ______________________��
(4)��ַ�Ӧ��������ƿ�еĻ����ͨ�����ķ��룬Ȼ��ˮϴ���������ˮ�Ҵ�ϴ�ӣ�����ˮ�Ҵ�ϴ�ӵ��ŵ���___________��Ϊ����֤�õ��Ĺ����dz�˳���Ե�Fe3O4���ӣ�ʵ�������_______________��Ϊ�˼��鳬˳���������к���+2�۵�������Ҫ�Ļ�ѧ�Լ�Ϊ___________(�����)��
A.KSCN��Һ B.HCl��Һ C.H2O2��Һ D.K3[Fe(CN)6]��Һ
(5)ʵ���Ƶõij�˳���Ե�Fe3O4�����к���������Fe(OH)3��Ϊ���Fe3O4�ĺ�������ȡmg����������С�ձ���������ϡ�����ܽ������100mL����ƿ�У�ȷ��ȡ���е�20.00mL��Һ������ƿ�У�Ȼ����cmol/L��KMnO4��Һ���еζ�����______________________ֹͣ�ζ���Ȼ���ظ����εζ���ƽ������KMnO4��Һ��mL������Ʒ�Ĵ���Ϊ___________��(��֪MnO4-+5Fe2++8H+=Mn2++5Fe3++4H2O)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪��CH4(g)+2O2(g)==CO2(g)+2H2O(1) ��H = �DQ1 kJ/mol
2H2(g)+O2(g)==2H2O(g) ��H = �DQ2 kJ/mol
2H2(g)+O2(g)==2H2O(1) ��H = �DQ3kJ/mol
�����£�ȡ�����Ϊ4:1�ļ���������Ļ������11.2L���ۺϳɱ�״����������ȫȼ�պ�ָ������£���ų�������Ϊ����kJ
A. 0.4Q1+0.05Q3 B. 0.4Q1+0.05Q2
C. 0.4Q1+0.1Q3 D. 0.4Q1+0.1Q2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��(1)��25����101 kPa�£�1 g�״�ȼ������CO2��Һ̬ˮʱ����22.68 kJ����÷�Ӧ��ȼ���ȵ��Ȼ�ѧ����ʽӦΪ_________________��
(2)��ѧ��Ӧ���ʱ��뷴Ӧ���������ļ����йء���ν���ܾ��ǣ���101kPa��298 Kʱ���Ͽ�1 mol��̬ABΪ��̬A����̬Bʱ���̵��ʱ䣬����H298(AB)��ʾ���Ͽ���ѧ��ʱ��H��0����H2(g)=2H(g) ��H= +436 kJ��mol-1�ݣ��γɻ�ѧ��ʱ��H��0[��2H(g)=H2(g) ��H= - 436 kJ��mol-1]��
��֪��H2(g)+Cl2(g)=2HCl(g) ��H= -185 kJ��mol-1 ��H298��H2��=+ 436 kJ��mol-1 ,��H298��Cl2��= +247 kJ��mol-1����H298��HCl��=__________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���¶�ΪT1ʱ��������X������Y��1.6mol����10L�����ܱ������У�������ӦX(g)+Y(g)![]() 2Z(g)��һ��ʱ���ﵽƽ�⡣��Ӧ�����вⶨ���������������˵����ȷ����
2Z(g)��һ��ʱ���ﵽƽ�⡣��Ӧ�����вⶨ���������������˵����ȷ����
t/min | 2 | 4 | 7 | 9 |
n��Y��/mol | 1.2 | 1.1 | 1.0 | 1.0 |
A. ��Ӧ0��4 min��ƽ�����ʦ�(Z)=0.25 mol/(Lmin)
B. T1ʱ����Ӧ��ƽ�ⳣ��K1��1.2
C. �����������䣬9 min�����������ٳ���1.6 molX��ƽ��������Ӧ�����ƶ����ٴδﵽƽ��ʱX��Ũ�ȼ�С��Y��ת��������
D. �����������䣬���µ�T2�ﵽƽ��ʱ��ƽ�ⳣ��K2=4����˷�Ӧ�ġ�H��0
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com