
【题目】下列有关热化学方程式及其叙述正确的是( )
A. 氢气的燃烧热为285.5 kJ·mol·-1,则水分解的热化学方程式为:2H2O(l)=2H2+O2(g)ΔH=+285.5 kJ·mol-1
B. 已知2C(石墨,s)+O2(g)=2CO(g)ΔH=-221 kJ·mol-1,则石墨的燃烧热为110.5 kJ·mol-1
C. 已知N2(g)+3H2(g) ![]() 2NH3(g)ΔH=-92.4 kJ·mol-1,则在一定条件下将1 mol N2和3 mol H2置于一密闭容器中充分反应后最多可放出92.4 kJ的热量
2NH3(g)ΔH=-92.4 kJ·mol-1,则在一定条件下将1 mol N2和3 mol H2置于一密闭容器中充分反应后最多可放出92.4 kJ的热量
D. 已知乙醇和乙烯的燃烧热分别为1 366.8 kJ·mol-1和1 411.0 kJ·mol-1,则乙烯水化制乙醇的热化学方程式为:C2H4(g)+H2O(l)=C2H5OH(l) ΔH=-44.2 kJ·mol-1
科目:高中化学 来源: 题型:
【题目】以熔融Li2CO3和K2CO3为电解质,天然气经重整催化作用提供反应气的燃料电池如右图。下列说法正确的是
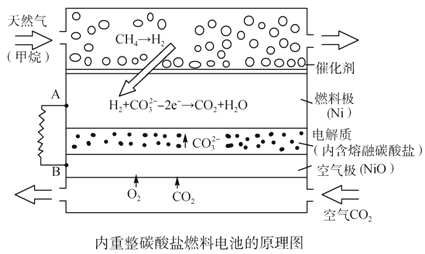
A. 以此电池为电源电解精炼铜,当有0.1 mol e- 转移时,有3.2 g铜溶解
B. 若以甲烷为燃料气时负极电极反应式:CH4+5O2--8e-=CO32-+2H2O
C. 该电池使用过程中需补充Li2CO3和K2CO3
D. 空气极发生的电极反应式为O2+4e-+2CO2===2CO32-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】10℃时加热NaHCO3饱和溶液,测得该溶液的pH发生如下变化:
温度(℃) | 10 | 20 | 30 | 加热煮沸后冷却到50℃ |
pH | 8.3 | 8.4 | 8.5 | 8.8 |
I.甲同学认为,该溶液的pH值升高的原因是HCO3-的水解程度增大,故碱性增强,该反应的离子方程式为 _____________________________。
II.乙同学认为,溶液pH升高的原因是NaHCO3受热分解,生成了Na2CO3,并推断Na2CO3的水解程度______(填“大于”或“小于”)NaHCO3。
丙同学认为甲、乙的判断都不充分。丙认为:
(1)只要在加热煮沸的溶液中加入足量的试剂X,若产生沉淀,则______(填“甲”或“乙”)判断正确,试剂X是______(填字母序号)。
A.Ba(OH) 2溶液B.BaCl2溶液C.NaOH溶液D.澄清石灰水。
(2)将加热后的溶液冷却到10℃,若溶液的pH______(填“高于”、“低于”或“等于”)8.3,则______(填“甲”或“乙”)判断正确。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I2在水中溶解度很小,在KI溶液中溶解度显著增大,其原因是I2在KI溶液中存在下列平衡:I2(aq)+I-(aq)![]() I3-(aq)。某I2、KI混合溶液中,I3-的浓度c(I3-)与温度(T)的关系如图所示(曲线上的任一点都表示平衡状态)。下列说法正确的是( )
I3-(aq)。某I2、KI混合溶液中,I3-的浓度c(I3-)与温度(T)的关系如图所示(曲线上的任一点都表示平衡状态)。下列说法正确的是( )

A. 反应I2(aq)+I-(aq)![]() I3-(aq)的ΔH>0
I3-(aq)的ΔH>0
B. 在上述平衡体系中加入CCl4,平衡不移动
C. 保持T1不变,若反应进行到d点时,一定有v正>v逆
D. T2℃时,在上述平衡体系中加入少量KI固体后,平衡常数K增加
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
丹参素是中药丹参的水溶性成分,结构为 F ,具有扩张血管、增加冠脉血流量等作用,某一种合成路线如下图所示:

已知:![]()
![]()
(1)丹参素的分子式为____________; D →E 的反应类型是_______________。
(2)试剂X是____________(写化学式);C 中含氧官能团名称为_____________。
(3) A→B 的反应方程式为________________。
(4)G与 E互为同分异构体,请写出满足下列条件的任意两种G的结构简式______________。
①lmolG 能与4molNaOH发生反应;
②能够发生水解反应;
③核磁共振氢谱显示5个吸收峰,且峰面积之比为 1 : 2 : 2 : 2 : 3 。
(5)参考上述流程信息,设计以![]() 、CH3CHO为原制取
、CH3CHO为原制取![]() 的合成路线(其它无机试剂任选)。________________
的合成路线(其它无机试剂任选)。________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中的一定量混合气体发生反应:xA(g)+yB(g)![]() zC(g)。平衡时测得A的浓度为0.50 mol/L,保持温度不变,将容器的容积扩大到原来的两倍,再达平衡时,测得A的浓度降低为0.30 mol/L。下列有关判断错误的是 ( )
zC(g)。平衡时测得A的浓度为0.50 mol/L,保持温度不变,将容器的容积扩大到原来的两倍,再达平衡时,测得A的浓度降低为0.30 mol/L。下列有关判断错误的是 ( )
A. x+y<z B. 平衡向逆反应方向移动
C. B的转化率降低 D. C的体积分数下降
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海洋植物如海带、海藻中含有丰富的碘元素,碘元素以碘离子的形式存在。实验室里从海藻中提取碘的流程如图:
![]() ―→
―→![]()
某化学兴趣小组将上述流程②③设计成如图所示:

已知②中发生反应的化学方程式为Cl2+2KI=2KCl+I2
回答下列问题:
(1)写出提取过程①③中实验操作名称:①____,③____。
(2)四氯化碳是____色、密度比水____的液体。Y中下层液体的颜色为___色,上层液体中溶质的主要成分为_____。
(3)从碘的四氯化碳溶液中得到碘需进行的操作是______。
(4)在操作①过程中,使用到的实验仪器有____(多选)。
A.试管 B.烧杯 C.玻璃棒 D.蒸发皿 E.漏斗 F.铁架台 G.分液漏斗
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外小组分别用下图所示装置对原电池和电解池原理进行实验探究。


请回答:
Ⅰ.用如图所示装置进行第一组实验。
(1)在保证电极反应不变的情况下,不能替代Cu作电极的是________(填序号)。
A.铝 B.石墨 C.银 D.铂
(2)N极发生反应的电极反应为________。
(3)实验过程中,SO42-________(填“从左向右”、“从右向左”或“不”)移动;滤纸上能观察到的现象有__________________。
Ⅱ.用图所示装置进行第二组实验。实验过程中,两极均有气体产生,Y极区溶液逐渐变成紫红色;停止实验,铁电极明显变细,电解液仍然澄清。查阅资料发现,高铁酸根(FeO42-)在溶液中呈紫红色。
(4)电解过程中,X极区溶液的pH________(填“增大”、“减小”或“不变”)。
(5)电解过程中,Y极发生的电极反应为Fe-6e-+8OH-==Fe+4H2O和_____________。
(6)在碱性锌电池中,用高铁酸钾作为正极材料,电池反应:2K2FeO4+3Zn===Fe2O3+ZnO+2K2ZnO2,该电池正极发生的反应的电极反应为________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】图为一种特殊的热激活电池示意图,当无水LiCl-KCl混合物受热熔融后即可工作。 该电池总反应为: PbSO4(s)+2LiCl+Ca(s) = CaCl2(s)+Li2SO4+Pb(s)。下列说法不正确的是
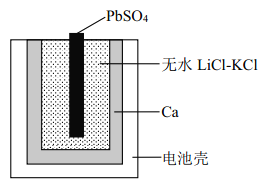
A. PbSO4 电极发生还原反应
B. 负极的电极反应:Ca + 2Cl--2e-=CaCl2
C. 放电时 Li+、 K+向正极移动
D. 用 LiCl 和 KCl 水溶液代替无水 LiCl-KCl,可将该电池改为常温使用的电池
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com