
【题目】雾霾天气的“罪魁祸首”是空气中的CO、NO、NO2等污染气体在大气中反应产生PM2.5 颗粒物,研究NO、NO2、CO 等污染物的处理,对环境保护有重要的意义。
(1)已知:
NO2(g)+CO(g) = CO2 (g)+NO(g) △H =-230.0kJ·mol-1
N2 (g)+O2 (g) = 2NO(g) △H =-180.0 kJ·mol-1
2NO(g)+O2 (g) = 2NO2 (g) △H =-112.3kJ·mol-1
若NO2气体和CO 气体反应生成无污染气体,其热化学方程式为_____。
(2) 由CO生成CO2的化学方程式为CO+O2![]() CO2+O。其正反应速率为v正=K正·c(CO) ·c(O2),逆反应速率为v逆=K逆·c(CO2) ·c(O),K正、K逆为速率常数。已知某一温度时,该反应的平衡常数K=0.40,K正=1.24×105 L·s-1·mol-1,此时K逆=_____L·s-1·mol-1。
CO2+O。其正反应速率为v正=K正·c(CO) ·c(O2),逆反应速率为v逆=K逆·c(CO2) ·c(O),K正、K逆为速率常数。已知某一温度时,该反应的平衡常数K=0.40,K正=1.24×105 L·s-1·mol-1,此时K逆=_____L·s-1·mol-1。
(3)汽车的排气管上安装“催化转化器”,其反应的热化学方程式为:2NO(g)+2CO(g) ![]() 2CO2(g)+N2(g) △H<0。T℃时,将等物质的量的NO 和CO 充入容积为2L 的密闭容器中,若温度和体积不变,反应过程中(0~15min) NO 的物质的量随时间变化如图。
2CO2(g)+N2(g) △H<0。T℃时,将等物质的量的NO 和CO 充入容积为2L 的密闭容器中,若温度和体积不变,反应过程中(0~15min) NO 的物质的量随时间变化如图。
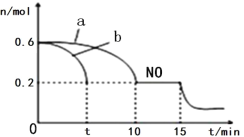
①图中a、b 分别表示在相同温度下,使用质量相同但表面积不同的催化剂时,达到平衡过程中n (NO)的变化曲线,其中表示催化剂表面积较大的曲线是________(填“a”或“b”) 。
②T℃时,该反应的化学平衡常数K=____;(保留小数点后一位小数)平衡时若保持温度不变,再向容器中充入CO、CO2各0.2 mol,则平衡将_____移动。(填“向左”、“向右”或“不”)
③15min 时,若改变外界反应条件,导致n (NO)发生图中所示变化,则改变的条件可能是_________(任答一条即可)。
(4)NO2可用氨水吸收生成NH4NO3。25℃时,将x mol NH4NO3溶于水,溶液显酸性,原因是_________用离子方程式表示)。向该溶液滴加c L 氨水后溶液呈中性,则所滴加氨水的浓度为_____molL﹣1。(NH3H2O 的电离平衡常数K =2×10﹣5 molL﹣1)
【答案】2NO2(g)+4CO(g) = 4CO2(g)+N2(g) △H=-852.3KJ/mol 3.1×105 b 40 L/mol 向右 增加 CO 的物质的量浓度减少生成物浓度或降温 NH4 + + H2 O![]() NH3·H2O+ H+
NH3·H2O+ H+ ![]()
【解析】
(1)根据盖斯定律写出热化学方程式;
(2)当v正= v逆时,反应达到平衡状态,K逆·c(CO2) ·c(O)= K正·c(CO) ·c(O2),则![]() =
= ![]() =K;
=K;
(3)①催化剂的表面积越大,催化效果越好,反应速率越大,反应时间越短;
②用三段式计算K,用Q和K的大小判断平衡移动方向

K=![]() =
=![]() =40;再向容器中充入CO、CO2各0.2 mol,Q=
=40;再向容器中充入CO、CO2各0.2 mol,Q=![]() =22.5,则平衡正向移动;
=22.5,则平衡正向移动;
③15min 时,若改变外界反应条件,导致n (NO)减小,反应正向进行,且改变条件瞬时n (NO)未变;
(4)NH4NO3为强酸弱碱盐,溶液中的铵根离子水解显酸性;向该溶液滴加c L 氨水后溶液呈中性,则c(H+)= c(OH-),根据溶液呈电中性,求出c(NH4+),根据K = 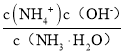 ,计算原氨水的浓度;
,计算原氨水的浓度;
(1)若NO2气体和CO 气体反应生成无污染气体,反应式:2NO2(g)+4CO(g)= N2 (g)+ 4CO2 (g),①NO2(g)+CO(g) = CO2 (g)+NO(g) △H =-230.0kJ·mol-1,②N2 (g)+O2 (g) = 2NO(g) △H =-180.0 kJ·mol-1,③2NO(g)+O2 (g) = 2NO2 (g) △H =-112.3kJ·mol-1,则4①-2②+③即可,△H=-230.0![]() -(-180.0)+(-112.3)=-852.3kJ/mol;答案为:2NO2(g)+4CO(g)= N2 (g)+ 4CO2 (g) △H=-852.3kJ/mol;
-(-180.0)+(-112.3)=-852.3kJ/mol;答案为:2NO2(g)+4CO(g)= N2 (g)+ 4CO2 (g) △H=-852.3kJ/mol;
(2)当v正= v逆时,反应达到平衡状态,K逆·c(CO2) ·c(O)= K正·c(CO) ·c(O2),则![]() =
= ![]() =K,K逆=
=K,K逆=![]() = 3.1×105;
= 3.1×105;
(3)①催化剂的表面积越大,催化效果越好,反应速率越大,反应时间越短,则答案为b;
②T℃时,
K=![]() =
=![]() =40;
=40;
再向容器中充入CO、CO2各0.2 mol,Q=![]() =22.5,则平衡正向移动;
=22.5,则平衡正向移动;
③15min 时,若改变外界反应条件,导致n (NO)发生图中所示变化,反应正向进行,且改变条件瞬时n (NO)未变,则增加 CO 的物质的量浓度减少生成物浓度或降温;
(4)NH4NO3为强酸弱碱盐,溶液中的铵根离子水解显酸性,离子反应为:NH4+ + H2 O=NH3·H2O+ H+;向该溶液滴加c L 氨水后溶液呈中性,则c(H+)= c(OH-),根据溶液呈电中性,c(NH4+)+c(H+)= c(OH-)+c(NO3-),可知c(NH4+)= c(NO3-),K = 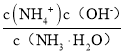 ,设混和溶液的体积为V,则c(NH4+)= c(NO3-)=
,设混和溶液的体积为V,则c(NH4+)= c(NO3-)=![]() ,此时溶液呈中性,c(OH-)=10-7mol/L,原氨水的浓度=
,此时溶液呈中性,c(OH-)=10-7mol/L,原氨水的浓度=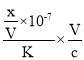 =
=![]() ;
;


科目:高中化学 来源: 题型:
【题目】已知某温度时CH3COOH的电离平衡常数为K。该温度下向20 mL 0.1 mol/L CH3COOH溶液中逐滴加入0.1 mol/L NaOH溶液,其pH变化曲线如图所示(忽略温度变化)。
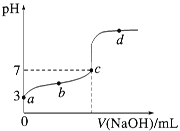
下列说法中正确的是
A.a点表示溶液中c(CH3COO-)约为10-3mol/L
B.b点表示的溶液中c(Na+)>c(CH3COO-)
C.c点表示CH3COOH和NaOH恰好反应完全
D.d点表示的溶液中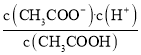 大于K
大于K
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关沉淀溶解平衡的说法正确的是
A.Ksp(AB2)小于Ksp(CD),则AB2的溶解度小于CD的溶解度
B.在氯化银的沉淀溶解平衡体系中,加入蒸馏水,氯化银的Ksp增大
C.在氯化银的沉淀溶解平衡体系中,加入碘化钾固体,氯化银沉淀可转化为碘化银沉淀
D.在碳酸钙的沉淀溶解平衡体系中,加入稀盐酸,溶解平衡不移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】淀粉通过如图所示转化可以得到多种有机物:
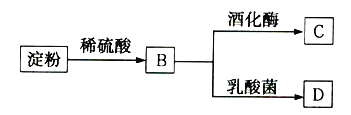
(1)检验淀粉是否完全水解,可以选用的试剂是__________(填序号)。
a.石蕊试液 b.淀粉碘化钾溶液 c.碘水
(2)B是一种单糖,则B的名称是____________________。
(3)B转化为C的化学方程式是______________________________。
(4)一分子B可在乳酸菌作用下分解生成两分子D,D与乙酸、乙醇均能发生酯化反应,且D的结构中含有甲基,则D的结构简式是______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中山大学中山医学院颜光美教授课题组发现一种叫![]() 的天然病毒(属于蛋白质),其能杀死癌细胞而不伤害正常细胞,该病毒含有C、H、O、N、S等元素,其直径大约为
的天然病毒(属于蛋白质),其能杀死癌细胞而不伤害正常细胞,该病毒含有C、H、O、N、S等元素,其直径大约为![]() 。下列说法不正确的是( )。
。下列说法不正确的是( )。
A.![]() 病毒中的C、H、O、N、S原子最有可能以共价键结合
病毒中的C、H、O、N、S原子最有可能以共价键结合
B.![]() 病毒不属于高分子化合物
病毒不属于高分子化合物
C.![]() 病毒溶于水形成的液体具有丁达尔效应
病毒溶于水形成的液体具有丁达尔效应
D.![]() 病毒在生物体内的水解产物可能是氨基酸
病毒在生物体内的水解产物可能是氨基酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于蔗糖属于非还原性糖,而其水解产物具有还原性的实验方案的说法正确的是( )。
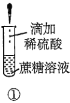
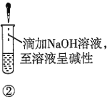
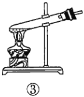
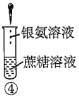
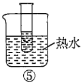
A.验证蔗糖属于非还原性糖的操作顺序:④③
B.验证蔗糖風于非还原性糖的操作顺序:④②③
C.验证蔗糖水解产物具有还原性的操作顺序:①④⑤
D.验证蔗糖水解产物具有还原性的操作顺序:①②④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应:X(s)+Y(g)![]() 2Z(g)在容积为1L密闭容器反应,下列叙述不是反应达到平衡状态的标志的是
2Z(g)在容积为1L密闭容器反应,下列叙述不是反应达到平衡状态的标志的是
①单位时间内生成1molX的同时消耗2molZ ②Z的体积分数不再变化
③体系的压强不再改变 ④Y、Z的物质的量浓度比为1:2
⑤Y的转化率不再改变的状态 ⑥混合气体的密度不再改变的状态
A. 仅①④ B. ①③④ C. ①④⑤ D. ②③⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某种碳酸锰矿的主要成分有MnCO3、MnO2、FeCO3、MgO、SiO2、Al2O3等.已知碳酸锰难溶于水.一种运用阴离子膜电解法的新技术可用于从碳酸锰矿中提取金属锰,流程如图1:阴离子膜法电解装置如图2所示:
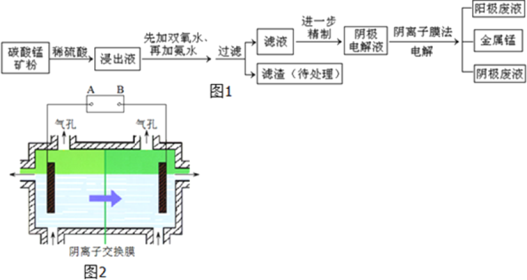
(1)写出用稀硫酸溶解碳酸锰反应的离子方程式______.
(2)已知不同金属离子生成氢氧化物沉淀所需的pH如表:
离子 | Fe3+ | Al3+ | Fe2+ | Mn2+ | Mg2+ |
开始沉淀的pH | 2.7 | 3.7 | 7.0 | 7.8 | 9.3 |
沉淀完全的pH | 3.7 | 4.7 | 9.6 | 9.8 | 10.8 |
加氨水调节溶液的pH等于6,则滤渣的成分是______,滤液中含有的阳离子有H+和______.
(3)在浸出液里锰元素只以Mn2+的形式存在,且滤渣中也无MnO2,请解释原因______.
(4)电解装置中箭头表示溶液中阴离子移动的方向,则A电极是直流电源的______极.实际生产中,阳极以稀硫酸为电解液,阳极的电极反应式为______.
(5)该工艺之所以采用阴离子交换膜,是为了防止Mn2+进入阳极区发生副反应生成MnO2造成资源浪费,写出该副反应的电极反应式______.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】N2H4是一种高效清洁的火箭燃料。已知在25℃、101kPa下,8gN2H4(g)完全燃烧生成氮气和液态水时,放出133.5 kJ热量。则下列热化学方程中正确的是( )
A. N2H4(g)+O2(g)=N2(g)+2H2O(g) △H=-534kJ·mol-1
B. N2H4(g)+O2(g)=N2(g)+2H2O(l) △H=-133.5kJ·mol-1
C. N2H4(g)+O2(g)=N2(g)+2H2O(l) △H=+534kJ·mol-1
D. N2H4(g)+O2(g)=N2(g)+2H2O(l) △H=-534kJ·mol-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com