
【题目】下列关于蔗糖属于非还原性糖,而其水解产物具有还原性的实验方案的说法正确的是( )。
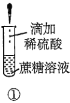
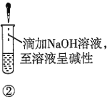
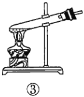
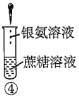
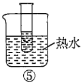
A.验证蔗糖属于非还原性糖的操作顺序:④③
B.验证蔗糖風于非还原性糖的操作顺序:④②③
C.验证蔗糖水解产物具有还原性的操作顺序:①④⑤
D.验证蔗糖水解产物具有还原性的操作顺序:①②④⑤
科目:高中化学 来源: 题型:
【题目】已知有机物: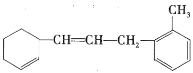 。
。
(1)该物质苯环上的一氯代物有________种。
(2)![]() 该物质和足量溴水混合,消耗
该物质和足量溴水混合,消耗![]() 的物质的量为________
的物质的量为________![]() 。
。
(3)![]() 该物质和
该物质和![]() 加成最多消耗
加成最多消耗![]() ________
________![]() 。
。
(4)下列说法不正确的是________(填序号)。
a.该有机物可发生加成、取代、氧化等反应
b.该有机物和甲苯属于同系物
c.该有机物使溴水褪色的原理与乙烯相同
d.该有机物能使酸性![]() 溶液褪色,发生的是加成反应
溶液褪色,发生的是加成反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应mA(固)+nB(气)![]() pC(气)+qD(气),反应过程中其它条件不变时C的百分含量C%与温度(T)和压强(P)的关系如图所示,下列叙述中正确的是
pC(气)+qD(气),反应过程中其它条件不变时C的百分含量C%与温度(T)和压强(P)的关系如图所示,下列叙述中正确的是
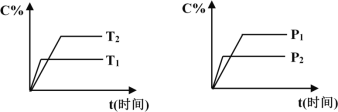
A. 达到平衡后,使用催化剂,C%将增大
B. 达到平衡后,若升高温度、化学平衡向逆反应方向移动
C. 方程式中n>p+q
D. 达到平衡后,增加A的量有利于化学平衡向正反应方向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】雾霾天气的“罪魁祸首”是空气中的CO、NO、NO2等污染气体在大气中反应产生PM2.5 颗粒物,研究NO、NO2、CO 等污染物的处理,对环境保护有重要的意义。
(1)已知:
NO2(g)+CO(g) = CO2 (g)+NO(g) △H =-230.0kJ·mol-1
N2 (g)+O2 (g) = 2NO(g) △H =-180.0 kJ·mol-1
2NO(g)+O2 (g) = 2NO2 (g) △H =-112.3kJ·mol-1
若NO2气体和CO 气体反应生成无污染气体,其热化学方程式为_____。
(2) 由CO生成CO2的化学方程式为CO+O2![]() CO2+O。其正反应速率为v正=K正·c(CO) ·c(O2),逆反应速率为v逆=K逆·c(CO2) ·c(O),K正、K逆为速率常数。已知某一温度时,该反应的平衡常数K=0.40,K正=1.24×105 L·s-1·mol-1,此时K逆=_____L·s-1·mol-1。
CO2+O。其正反应速率为v正=K正·c(CO) ·c(O2),逆反应速率为v逆=K逆·c(CO2) ·c(O),K正、K逆为速率常数。已知某一温度时,该反应的平衡常数K=0.40,K正=1.24×105 L·s-1·mol-1,此时K逆=_____L·s-1·mol-1。
(3)汽车的排气管上安装“催化转化器”,其反应的热化学方程式为:2NO(g)+2CO(g) ![]() 2CO2(g)+N2(g) △H<0。T℃时,将等物质的量的NO 和CO 充入容积为2L 的密闭容器中,若温度和体积不变,反应过程中(0~15min) NO 的物质的量随时间变化如图。
2CO2(g)+N2(g) △H<0。T℃时,将等物质的量的NO 和CO 充入容积为2L 的密闭容器中,若温度和体积不变,反应过程中(0~15min) NO 的物质的量随时间变化如图。
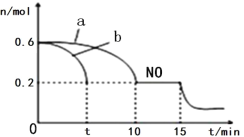
①图中a、b 分别表示在相同温度下,使用质量相同但表面积不同的催化剂时,达到平衡过程中n (NO)的变化曲线,其中表示催化剂表面积较大的曲线是________(填“a”或“b”) 。
②T℃时,该反应的化学平衡常数K=____;(保留小数点后一位小数)平衡时若保持温度不变,再向容器中充入CO、CO2各0.2 mol,则平衡将_____移动。(填“向左”、“向右”或“不”)
③15min 时,若改变外界反应条件,导致n (NO)发生图中所示变化,则改变的条件可能是_________(任答一条即可)。
(4)NO2可用氨水吸收生成NH4NO3。25℃时,将x mol NH4NO3溶于水,溶液显酸性,原因是_________用离子方程式表示)。向该溶液滴加c L 氨水后溶液呈中性,则所滴加氨水的浓度为_____molL﹣1。(NH3H2O 的电离平衡常数K =2×10﹣5 molL﹣1)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】ClO2是一种黄绿色或橙黄色的气体,极易溶于水,可用于水的消毒杀菌、水体中Mn2+等重金属清除及烟气的脱硫脱硝。回答下列问题:
(1)将过硫酸钠(Na2S2O8)溶液加入亚氯酸钠(NaClO2)中可制备ClO2,该反应中氧化剂和还原剂的物质的量之比为_____。
(2)将ClO2通入MnSO4溶液,溶液中可检测到Cl-同时有黑色沉淀生成。该反应的离子方程式为__________。
(3)为研究ClO2脱硝的适宜条件,在1L200 mgL-1 ClO2溶液中加NaOH溶液调节pH,通入NO气体并测定NO的去除率,脱硝后N元素以NO3-形式存在,其关系如下图所示:
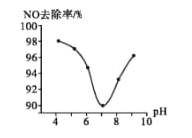
①实验中使用的ClO2溶液的物质的量浓度为______(保留三位有效数字);要使NO的去除率更高,应控制的条件是_________。
②当溶液pH>7时,NO的去除率增大的原因是ClO2与NaOH溶液反应可生成更强的吸收剂NaClO2,写出碱性条件下NaClO2脱除NO反应的离子方程式:_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有ABC三种物质的无色溶液,它们分别为葡萄糖溶液、蔗糖溶液、淀粉溶液中的一种,经实验可知:
①B能发生银镜反应;②A遇碘水变蓝色;③AC均能发生水解反应,水解产物中均有能发生银镜反应的物质。
(1)写出下列各物质的名称:
A是________,B是________,C是________。
(2)分别写出A、C发生水解反应的化学方程式。
A:________________。C:________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某含镍(Ni)废催化剂中主要含有Ni,还含有Al、Al2O3、Fe及其它不溶于酸、碱的杂质。部分金属氢氧化物Ksp近似值如下表所示:
化学式 | Fe(OH)2 | Fe(OH)3 | Al(OH)3 | Ni(OH)2 |
Ksp近似值 | 10-17 | 10-39 | 10-34 | 10-15 |
现用含镍废催化剂制备NiSO47H2O晶体,其流程图如下:
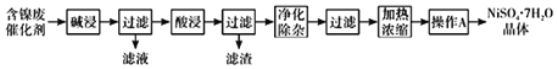
回答下列问题:
(1)“碱浸”时发生反应的离子方程式为______。
(2)“酸浸”所使用的酸为______。
(3)“净化除杂”需加入H2O2溶液,其作用是______。然后调节pH使溶液中铁元素恰好完全沉淀,列式计算此时的pH。______
(4)“操作A”为______、过滤、洗涤、干燥,即得产品。
(5)NiSO4在强碱性溶液中可被NaClO氧化为NiOOH,该反应的离子方程式为______。
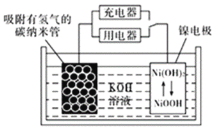
(6)NiOOH可作为镍氢电池的电极材料,该电池的工作原理如图所示,其放电时,正极的电极反应式为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮元素是重要的非金属元素,可形成卤化物、氮化物,叠氮化物及配合物等多种化合物。
(1)NF3、NBr3、NCl3的沸点由高到低的顺序是______,这三种化台物中N原子的杂化类型是______,分子的空间构型是______
(2)N、F、Br三种元素的电负性由大到小顺序为____________
(3)叠氮酸(HN3)是一种弱酸。可部分电离出H+和N3-,请写出两种与N3-互为等电子体的分子______
(4)Fe2+、Cu2+、Co3+等过渡金属离子都能与叠氮化物、氰化物形成配合物。Fe2+的核外电子排布式为______;配合物[Co(N3)(NH3)5]SO4中Co的配位数为______,Co3+与NH3之间的作用力是______
(5)NaN3与KN3相比,NaN3的晶格能______KN3的晶格能(填“>”、“=”或“<”)+
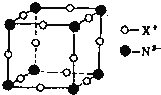
(6)某元素X与N形成的氮化物中,X+中K、L、M三个电子层均充满了电子。它与N3-形成晶体的结构如图所示,X+的符号是______,晶体中每个N3-与其距离最近的X+有______个。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com