
【题目】ClO2是一种黄绿色或橙黄色的气体,极易溶于水,可用于水的消毒杀菌、水体中Mn2+等重金属清除及烟气的脱硫脱硝。回答下列问题:
(1)将过硫酸钠(Na2S2O8)溶液加入亚氯酸钠(NaClO2)中可制备ClO2,该反应中氧化剂和还原剂的物质的量之比为_____。
(2)将ClO2通入MnSO4溶液,溶液中可检测到Cl-同时有黑色沉淀生成。该反应的离子方程式为__________。
(3)为研究ClO2脱硝的适宜条件,在1L200 mgL-1 ClO2溶液中加NaOH溶液调节pH,通入NO气体并测定NO的去除率,脱硝后N元素以NO3-形式存在,其关系如下图所示:
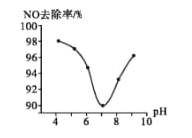
①实验中使用的ClO2溶液的物质的量浓度为______(保留三位有效数字);要使NO的去除率更高,应控制的条件是_________。
②当溶液pH>7时,NO的去除率增大的原因是ClO2与NaOH溶液反应可生成更强的吸收剂NaClO2,写出碱性条件下NaClO2脱除NO反应的离子方程式:_________。
【答案】1:2 2ClO2+5Mn2++6H2O=5MnO2↓+12H++2Cl- 2.96×10-3 molL-1 控制溶液呈强酸性或强碱性 4NO+3ClO2-+4OH-=4NO3-+3Cl-+2H2O
【解析】
(1)NaClO2中正负化合价代数和为0,该反应中过硫酸钠(Na2S2O8)中S元素的化合价由+7价降低为+6价,过硫酸钠为氧化剂,亚氯酸钠(NaClO2)中Cl的化合价由+3价升高为+4价,亚氯酸钠为还原剂,结合得失电子守恒计算;
(2)将ClO2通入MnSO4溶液中可检测到Cl-同时有黑色MnO2沉淀生成,Cl元素的化合价降低、Mn元素的化合价升高;
(3)①根据n=m/M、c=n/V以及图象分析解答;
②当溶液pH>7时,NO的去除率增大的原因是ClO2与NaOH溶液反应可生成更强的吸收剂NaClO2,N元素的化合价升高、Cl元素的化合价降低。
(1)将过硫酸钠(Na2S2O8)溶液加入亚氯酸钠(NaClO2)中可制备ClO2,NaClO2中Cl元素的化合价为+3价,该反应中过硫酸钠(Na2S2O8)中S元素的化合价由+7价降低为+6价,过硫酸钠为氧化剂,亚氯酸钠(NaClO2)中Cl的化合价由+3价升高为+4价,亚氯酸钠为还原剂,根据得失电子守恒,过硫酸钠与亚氯酸钠的物质的量之比为1:2;
(2)将ClO2通入MnSO4溶液中可检测到Cl-同时有黑色MnO2沉淀生成,反应的离子方程式为2ClO2+5Mn2++6H2O=5MnO2↓+12H++2Cl-;
(3)①200 mg ClO2的物质的量n(ClO2)=0.2g÷67.5g/mol=0.00296mol,溶液体积为1L,因此ClO2溶液的物质的量浓度为2.96×10-3molL-1,根据图象,要使NO的去除率更高,应该控制溶液呈强酸性或强碱性;
②当溶液pH>7时,NO的去除率增大的原因是ClO2与NaOH溶液反应可生成更强的吸收剂NaC1O2,在碱性条件下NaClO2脱除NO反应的离子方程式为4NO+3ClO2-+4OH-=4NO3-+3Cl-+2H2O。


 培优三好生系列答案
培优三好生系列答案 优化作业上海科技文献出版社系列答案
优化作业上海科技文献出版社系列答案科目:高中化学 来源: 题型:
【题目】列关于古籍中的记载说法正确的是( )
A.直径为20 nm的纳米碳酸钙属于胶体
B.氢化钙的电子式是:Ca2+[∶H]2-
C.“千锤万凿出深山,烈火焚烧若等闲。”这句古诗包含了吸热反应过程
D.《本草经集注》中关于鉴别硝石(KNO3)和朴硝(Na2SO4)的记载:“以火烧之,紫青烟起,乃真硝石也”,该方法应用了显色反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乳酸亚铁晶体![]() 是一种很好的食品铁强化剂,易溶于水,吸收效果比无机铁好,可由乳酸与
是一种很好的食品铁强化剂,易溶于水,吸收效果比无机铁好,可由乳酸与![]() 反应制得:
反应制得:![]() 。
。
I. 制备![]() :装置如下图所示:
:装置如下图所示:
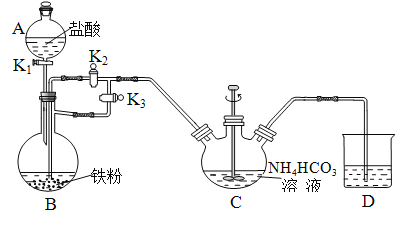
⑴B的名称是________________。
⑵①清洗仪器,检查装置的气密性。
②实验操作:在A中加入盐酸,B中加入铁粉、C中加入![]() 溶液。关闭活塞______(填
溶液。关闭活塞______(填![]() 或
或![]() ,下同)打开活塞______,滴入足量盐酸后,关闭活塞
,下同)打开活塞______,滴入足量盐酸后,关闭活塞![]() ,开动搅拌器,反应一段时间后关闭活塞______、打开活塞_______。
,开动搅拌器,反应一段时间后关闭活塞______、打开活塞_______。
C中发生的反应的离子方程式为_______________________________________。
Ⅱ.制备乳酸亚铁晶体:将制得的![]() 加入乳酸溶液中,加入少量铁粉,在
加入乳酸溶液中,加入少量铁粉,在![]() 下搅拌使之充分反应。然后再加入适量乳酸。
下搅拌使之充分反应。然后再加入适量乳酸。
⑶加入少量铁粉的作用是___________________________________。从所得溶液中获得乳酸亚铁晶体所需的实验操作是:隔绝空气低温蒸发,冷却结晶,______、______、干燥。
Ⅲ.乳酸亚铁晶体纯度的测量:
⑷若用![]() 滴定法测定样品中
滴定法测定样品中![]() 的量进而计算纯度时,发现结果总是大于
的量进而计算纯度时,发现结果总是大于![]() ,其原因可能是_________________________。
,其原因可能是_________________________。
⑸经查阅文献后,改用![]() 标准溶液滴定进行测定。反应中
标准溶液滴定进行测定。反应中![]() 离子的还原产物为
离子的还原产物为![]() 。测定时,先称取
。测定时,先称取![]() 样品溶解后进行必要处理,配制成250mL溶液,每次取
样品溶解后进行必要处理,配制成250mL溶液,每次取![]() ,用
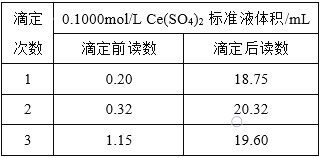
,用![]() 标准溶液滴定至终点,记录数据如右表。则产品中乳酸亚铁晶体的纯度为:____________
标准溶液滴定至终点,记录数据如右表。则产品中乳酸亚铁晶体的纯度为:____________![]() 以质量分数表示,乳酸亚铁式量为
以质量分数表示,乳酸亚铁式量为![]() 。
。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下在密闭容器中发生如下可逆反应:2M(g)+N(g)![]() 2E(g),若开始时只充入2mol E(g),达平衡时,E的转化率为40%;若开始时充入2mol M和1mol N的混合气体,达平衡时混合气体的压强比起始时减少了( )
2E(g),若开始时只充入2mol E(g),达平衡时,E的转化率为40%;若开始时充入2mol M和1mol N的混合气体,达平衡时混合气体的压强比起始时减少了( )
A.20%B.40%C.60%D.80%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于蔗糖属于非还原性糖,而其水解产物具有还原性的实验方案的说法正确的是( )。
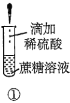
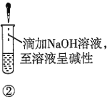
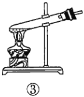
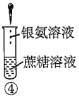
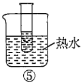
A.验证蔗糖属于非还原性糖的操作顺序:④③
B.验证蔗糖風于非还原性糖的操作顺序:④②③
C.验证蔗糖水解产物具有还原性的操作顺序:①④⑤
D.验证蔗糖水解产物具有还原性的操作顺序:①②④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向1L的密闭容器中加入1mol X、0.3molZ和一定量的Y三种气体,一定条件下发生反应,各物质的浓度随时间变化如图一所示,图二为t2时刻后改变反应条件,平衡体系中反应速率随时间变化的情况,且四个阶段都各改变一种不同的条件。下列说法不正确的是
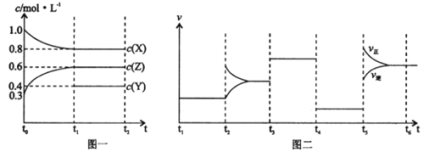
A.Y的起始物质的量为0.5mol
B.该反应化学方程式为:2X(g)+Y(g)![]() 3Z(g) ΔH<0
3Z(g) ΔH<0
C.若t0=0,t1=10min,则t0~t1阶段的平均反应速率为v(Z)=0.03mol·(L·min)-1
D.反应物X的转化率t6点比t3点高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组用如图所示装置进行乙醇的催化氧化实验。

(1)实验过程中铜网出现红色和黑色交替的现象,请写出相应的化学方程式________。在不断鼓入空气的情况下,熄灭酒精灯,反应仍能继续进行,说明该反应是________反应(填“吸热”或“放热”)。
(2)甲和乙两个水浴作用不相同:甲的作用是________;乙的作用是________。
(3)反应进行一段时间后,干燥试管a中能收集到不同的物质,它们是________________,集气瓶中收集到的主要成分是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应aA(s)+bB(g)![]() cC(g) +dD(g), 当其他条件不变时,某物质在混合物中的含量与温度(T)、压强(p)的关系如图所示,以下正确的是( )
cC(g) +dD(g), 当其他条件不变时,某物质在混合物中的含量与温度(T)、压强(p)的关系如图所示,以下正确的是( )
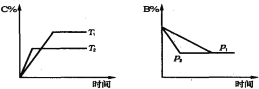
A. T1>T2,正反应放热
B. Tl<T2,正反应吸热
C. P1>P2,a+b>c+d
D. Pl<P2,b=c+d
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有一种节能的氯碱工业新工艺,将电解池与燃料电池相组合,相关流程如图所示(电极未标出)。回答下列有关问题:
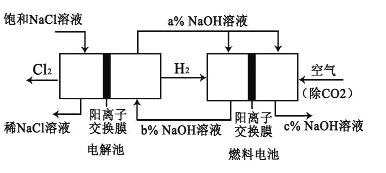
(1)电解池的阴极反应式为_____________。
(2)通入空气一极的电极反应式为_____________。燃料电池中阳离子的移动方向是_____________ (“从左向右”或“从右向左”)。
(3)电解池中产生 2molCl2,理论上燃料电池中消耗标准状况下_____________LO2。
(4) a、b、c 由大到小的顺序为:_____________。
(5)二氧化氯是目前国际上公认的第四代高效、无毒的广谱消毒剂,可由 KClO3在H2SO4存在下与 Na2SO3反应制得。请写出反应的离子方程式_____________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com