
ΓΨΧβΡΩΓΩ»ιΥα―«ΧζΨßΧε![]() «“Μ÷÷ΚήΚΟΒΡ ≥ΤΖΧζ«ΩΜ·ΦΝΘ§“Ή»ή”ΎΥ°Θ§Έϋ ’–ßΙϊ±»ΈόΜζΧζΚΟΘ§Ω…”…»ιΥα”κ
«“Μ÷÷ΚήΚΟΒΡ ≥ΤΖΧζ«ΩΜ·ΦΝΘ§“Ή»ή”ΎΥ°Θ§Έϋ ’–ßΙϊ±»ΈόΜζΧζΚΟΘ§Ω…”…»ιΥα”κ![]() Ζ¥”Π÷ΤΒΟΘΚ
Ζ¥”Π÷ΤΒΟΘΚ![]() ΓΘ
ΓΘ
I. ÷Τ±Η![]() ΘΚΉΑ÷Ο»γœ¬ΆΦΥυ ΨΘΚ
ΘΚΉΑ÷Ο»γœ¬ΆΦΥυ ΨΘΚ
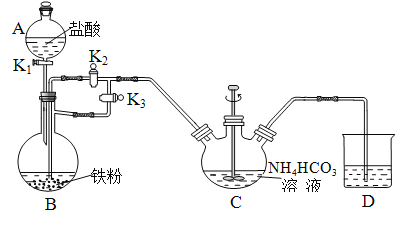
Δ≈BΒΡΟϊ≥Τ «________________ΓΘ
ΔΤΔΌ«εœ¥“«ΤςΘ§Φλ≤ιΉΑ÷ΟΒΡΤχΟή–‘ΓΘ
ΔΎ Β―ι≤ΌΉςΘΚ‘ΎA÷–Φ”»κ―ΈΥαΘ§B÷–Φ”»κΧζΖέΓΔC÷–Φ”»κ![]() »ή“ΚΓΘΙΊ±’Μν»ϊ______(Χν
»ή“ΚΓΘΙΊ±’Μν»ϊ______(Χν![]() Μρ
Μρ![]() Θ§œ¬Ά§)¥ρΩΣΜν»ϊ______Θ§ΒΈ»κΉψΝΩ―ΈΥαΚσΘ§ΙΊ±’Μν»ϊ
Θ§œ¬Ά§)¥ρΩΣΜν»ϊ______Θ§ΒΈ»κΉψΝΩ―ΈΥαΚσΘ§ΙΊ±’Μν»ϊ![]() Θ§ΩΣΕ·ΫΝΑηΤςΘ§Ζ¥”Π“ΜΕΈ ±ΦδΚσΙΊ±’Μν»ϊ______ΓΔ¥ρΩΣΜν»ϊ_______ΓΘ
Θ§ΩΣΕ·ΫΝΑηΤςΘ§Ζ¥”Π“ΜΕΈ ±ΦδΚσΙΊ±’Μν»ϊ______ΓΔ¥ρΩΣΜν»ϊ_______ΓΘ
C÷–ΖΔ…ζΒΡΖ¥”ΠΒΡάκΉ”ΖΫ≥Χ ΫΈΣ_______________________________________ΓΘ
Δρ.÷Τ±Η»ιΥα―«ΧζΨßΧεΘΚΫΪ÷ΤΒΟΒΡ![]() Φ”»κ»ιΥα»ή“Κ÷–Θ§Φ”»κ…ΌΝΩΧζΖέΘ§‘Ύ
Φ”»κ»ιΥα»ή“Κ÷–Θ§Φ”»κ…ΌΝΩΧζΖέΘ§‘Ύ![]() œ¬ΫΝΑη Ι÷°≥δΖ÷Ζ¥”ΠΓΘ»ΜΚσ‘ΌΦ”»κ ΝΩ»ιΥαΓΘ
œ¬ΫΝΑη Ι÷°≥δΖ÷Ζ¥”ΠΓΘ»ΜΚσ‘ΌΦ”»κ ΝΩ»ιΥαΓΘ
Δ«Φ”»κ…ΌΝΩΧζΖέΒΡΉς”Ο «___________________________________ΓΘ¥”ΥυΒΟ»ή“Κ÷–ΜώΒΟ»ιΥα―«ΧζΨßΧεΥυ–ηΒΡ Β―ι≤ΌΉς «ΘΚΗτΨχΩ’ΤχΒΆΈ¬’τΖΔΘ§ά以ΫαΨßΘ§______ΓΔ______ΓΔΗ…‘οΓΘ
Δσ.»ιΥα―«ΧζΨßΧε¥ΩΕ»ΒΡ≤βΝΩΘΚ
Δ»»τ”Ο![]() ΒΈΕ®Ζ®≤βΕ®―υΤΖ÷–
ΒΈΕ®Ζ®≤βΕ®―υΤΖ÷–![]() ΒΡΝΩΫχΕχΦΤΥψ¥ΩΕ» ±Θ§ΖΔœ÷ΫαΙϊΉή «¥σ”Ύ
ΒΡΝΩΫχΕχΦΤΥψ¥ΩΕ» ±Θ§ΖΔœ÷ΫαΙϊΉή «¥σ”Ύ![]() Θ§Τδ‘≠“ρΩ…Ρή «_________________________ΓΘ
Θ§Τδ‘≠“ρΩ…Ρή «_________________________ΓΘ
Δ…Ψ≠≤ι‘ΡΈΡœΉΚσΘ§ΗΡ”Ο![]() ±ξΉΦ»ή“ΚΒΈΕ®Ϋχ––≤βΕ®ΓΘΖ¥”Π÷–
±ξΉΦ»ή“ΚΒΈΕ®Ϋχ––≤βΕ®ΓΘΖ¥”Π÷–![]() άκΉ”ΒΡΜΙ‘≠≤ζΈοΈΣ
άκΉ”ΒΡΜΙ‘≠≤ζΈοΈΣ![]() ΓΘ≤βΕ® ±Θ§œ»≥Τ»Γ
ΓΘ≤βΕ® ±Θ§œ»≥Τ»Γ![]() ―υΤΖ»ήΫβΚσΫχ––±Ί“Σ¥ΠάμΘ§≈δ÷Τ≥…250mL»ή“ΚΘ§ΟΩ¥Έ»Γ
―υΤΖ»ήΫβΚσΫχ––±Ί“Σ¥ΠάμΘ§≈δ÷Τ≥…250mL»ή“ΚΘ§ΟΩ¥Έ»Γ![]() Θ§”Ο
Θ§”Ο![]() ±ξΉΦ»ή“ΚΒΈΕ®÷Ν÷’ΒψΘ§Φ«¬Φ ΐΨί»γ”“±μΓΘ‘ρ≤ζΤΖ÷–»ιΥα―«ΧζΨßΧεΒΡ¥ΩΕ»ΈΣΘΚ____________
±ξΉΦ»ή“ΚΒΈΕ®÷Ν÷’ΒψΘ§Φ«¬Φ ΐΨί»γ”“±μΓΘ‘ρ≤ζΤΖ÷–»ιΥα―«ΧζΨßΧεΒΡ¥ΩΕ»ΈΣΘΚ____________![]() “‘÷ ΝΩΖ÷ ΐ±μ ΨΘ§»ιΥα―«Χζ ΫΝΩΈΣ
“‘÷ ΝΩΖ÷ ΐ±μ ΨΘ§»ιΥα―«Χζ ΫΝΩΈΣ![]() ΓΘ
ΓΘ
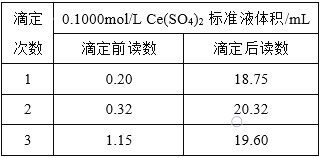
ΓΨ¥πΑΗΓΩ’τΝσ…’ΤΩ![]() ΜρΨΏ÷ß…’ΤΩ
ΜρΨΏ÷ß…’ΤΩ![]()
![]()
![]()
![]()
![]()
![]() Ζά÷Ι
Ζά÷Ι![]() ”κ»ιΥαΖ¥”Π≤ζ…ζΒΡ
”κ»ιΥαΖ¥”Π≤ζ…ζΒΡ![]() ±Μ―θΜ· Ιΐ¬Υ œ¥Β” »ιΥαΗυ÷–τ«Μυ
±Μ―θΜ· Ιΐ¬Υ œ¥Β” »ιΥαΗυ÷–τ«Μυ![]() ±ΜΥα–‘ΗΏΟΧΥαΦΊ»ή“Κ―θΜ·
±ΜΥα–‘ΗΏΟΧΥαΦΊ»ή“Κ―θΜ· ![]() ΓΘ
ΓΘ
ΓΨΫβΈωΓΩ
Δ≈”…“«ΤςBΒΡΫαΙΙΧΊ’ςΘ§Ω…÷ΣBΟϊ≥ΤΓΘ
ΔΤœ»Ζ¥”Π…ζ≥…«βΤχΘ§≈≈≥ΐΉΑ÷ΟΡΎΩ’ΤχΘ§‘Όάϊ”Ο…ζ≥…«βΤχΘ§ ΙBΉΑ÷Ο÷–Τχ―Ι‘ω¥σΘ§ΫΪBΉΑ÷Ο÷–ΒΡ¬»Μ·―«Χζ»ή“Κ―Ι»κC÷–Θ§CΉΑ÷Ο÷–![]() ΚΆ
ΚΆ![]() ΖΔ…ζΖ¥”ΠΓΘ
ΖΔ…ζΖ¥”ΠΓΘ
Δ«![]() άκΉ”“Ή±Μ―θΜ·ΈΣ
άκΉ”“Ή±Μ―θΜ·ΈΣ![]() άκΉ”Θ§Φ”»κFeΖέΘ§Ζά÷Ι
άκΉ”Θ§Φ”»κFeΖέΘ§Ζά÷Ι![]() άκΉ”±Μ―θΜ·Θ§¥”ΥυΒΟ»ή“Κ÷–ΜώΒΟ»ιΥα―«ΧζΨßΧεΥυ–ηΒΡ Β―ι≤ΌΉς «ΗτΨχΩ’ΤχΒΆΈ¬’τΖΔΓΔά以ΫαΨßΓΔΙΐ¬ΥΓΔœ¥Β”ΓΔΗ…‘οΓΘ
άκΉ”±Μ―θΜ·Θ§¥”ΥυΒΟ»ή“Κ÷–ΜώΒΟ»ιΥα―«ΧζΨßΧεΥυ–ηΒΡ Β―ι≤ΌΉς «ΗτΨχΩ’ΤχΒΆΈ¬’τΖΔΓΔά以ΫαΨßΓΔΙΐ¬ΥΓΔœ¥Β”ΓΔΗ…‘οΓΘ
Δ»»ιΥαΗυ÷–Κ§”–τ«ΜυΘ§Ω…“‘±ΜΥα–‘ΗΏΟΧΥαΦΊ»ή“Κ―θΜ·Θ§ΒΦ÷¬œϊΚΡΗΏΟΧΥαΦΊΒΡ‘ω¥σΘ§ΕχΦΤΥψ÷–Α¥―«ΧζάκΉ”±Μ―θΜ·ΓΘ
Δ…œ»Υψ≥ωΤΫΨυ÷ΒΘ§‘ΌΗυΨίΖΫ≥Χ ΫΫχ––ΦΤΥψΓΘ
Δ≈”…“«ΤςBΒΡΫαΙΙΧΊ’ςΘ§Ω…÷ΣBΈΣ’τΝσ…’ΤΩ(ΜρΨΏ÷ß…’ΤΩ)ΘΜΙ ¥πΑΗΈΣΘΚ’τΝσ…’ΤΩ(ΜρΨΏ÷ß…’ΤΩ)ΓΘ
ΔΤΙΊ±’Μν»ϊ![]() Θ§¥ρΩΣΜν»ϊ
Θ§¥ρΩΣΜν»ϊ![]() Θ§Φ”»κΉψΝΩ―ΈΥαΚσΘ§ΙΊ±’Μν»ϊ
Θ§Φ”»κΉψΝΩ―ΈΥαΚσΘ§ΙΊ±’Μν»ϊ![]() Θ§Ζ¥”Π“ΜΕΈ ±ΦδΚσΙΊ±’Μν»ϊ
Θ§Ζ¥”Π“ΜΕΈ ±ΦδΚσΙΊ±’Μν»ϊ![]() Θ§¥ρΩΣΜν»ϊ
Θ§¥ρΩΣΜν»ϊ![]() Θ§άϊ”Ο…ζ≥…«βΤχΘ§ ΙBΉΑ÷Ο÷–Τχ―Ι‘ω¥σΘ§ΫΪBΉΑ÷Ο÷–ΒΡ¬»Μ·―«Χζ»ή“Κ―Ι»κC÷–Θ§CΉΑ÷Ο÷–
Θ§άϊ”Ο…ζ≥…«βΤχΘ§ ΙBΉΑ÷Ο÷–Τχ―Ι‘ω¥σΘ§ΫΪBΉΑ÷Ο÷–ΒΡ¬»Μ·―«Χζ»ή“Κ―Ι»κC÷–Θ§CΉΑ÷Ο÷–![]() ΚΆ
ΚΆ![]() ΖΔ…ζΖ¥”ΠΘΚ
ΖΔ…ζΖ¥”ΠΘΚ![]() Θ§Ζ¥”ΠάκΉ”ΖΫ≥Χ ΫΈΣΘΚ
Θ§Ζ¥”ΠάκΉ”ΖΫ≥Χ ΫΈΣΘΚ![]() ΘΜΙ ¥πΑΗΈΣΘΚ
ΘΜΙ ¥πΑΗΈΣΘΚ![]() ΘΜ
ΘΜ![]() ΘΜ
ΘΜ![]() ΘΜ
ΘΜ![]() ΘΜ
ΘΜ![]() ΓΘ
ΓΘ
Δ«![]() άκΉ”“Ή±Μ―θΜ·ΈΣ
άκΉ”“Ή±Μ―θΜ·ΈΣ![]() άκΉ”Θ§ Β―ιΡΩΒΡ «÷Τ±Η»ιΥα―«ΧζΨßΧεΘ§Φ”»κFeΖέΘ§Ζά÷Ι
άκΉ”Θ§ Β―ιΡΩΒΡ «÷Τ±Η»ιΥα―«ΧζΨßΧεΘ§Φ”»κFeΖέΘ§Ζά÷Ι![]() άκΉ”±Μ―θΜ·Θ§¥”ΥυΒΟ»ή“Κ÷–ΜώΒΟ»ιΥα―«ΧζΨßΧεΥυ–ηΒΡ Β―ι≤ΌΉς «ΗτΨχΩ’ΤχΒΆΈ¬’τΖΔΓΔά以ΫαΨßΓΔΙΐ¬ΥΓΔœ¥Β”ΓΔΗ…‘οΘΜΙ ¥πΑΗΈΣΘΚΖά÷Ι
άκΉ”±Μ―θΜ·Θ§¥”ΥυΒΟ»ή“Κ÷–ΜώΒΟ»ιΥα―«ΧζΨßΧεΥυ–ηΒΡ Β―ι≤ΌΉς «ΗτΨχΩ’ΤχΒΆΈ¬’τΖΔΓΔά以ΫαΨßΓΔΙΐ¬ΥΓΔœ¥Β”ΓΔΗ…‘οΘΜΙ ¥πΑΗΈΣΘΚΖά÷Ι![]() ”κ»ιΥαΖ¥”Π≤ζ…ζΒΡ
”κ»ιΥαΖ¥”Π≤ζ…ζΒΡ ![]() ±Μ―θΜ·ΘΜΙΐ¬ΥΘΜœ¥Β”ΓΘ
±Μ―θΜ·ΘΜΙΐ¬ΥΘΜœ¥Β”ΓΘ
Δ»»ιΥαΗυ÷–Κ§”–τ«ΜυΘ§Ω…“‘±ΜΥα–‘ΗΏΟΧΥαΦΊ»ή“Κ―θΜ·Θ§ΒΦ÷¬œϊΚΡΗΏΟΧΥαΦΊΒΡ‘ω¥σΘ§ΕχΦΤΥψ÷–Α¥―«ΧζάκΉ”±Μ―θΜ·Θ§Ι ΦΤΥψΥυΒΟ»ιΥα―«ΧζΒΡ÷ ΝΩΤΪ¥σΘ§≤ζΤΖ÷–»ιΥα―«ΧζΒΡ÷ ΝΩΖ÷ ΐΜα¥σ”Ύ![]() ΘΜΙ ¥πΑΗΈΣΘΚ»ιΥαΗυ÷–τ«Μυ
ΘΜΙ ¥πΑΗΈΣΘΚ»ιΥαΗυ÷–τ«Μυ![]() ±ΜΥα–‘ΗΏΟΧΥαΦΊ»ή“Κ―θΜ·ΓΘ
±ΜΥα–‘ΗΏΟΧΥαΦΊ»ή“Κ―θΜ·ΓΘ
Δ…»ΐ¥ΈœϊΚΡ![]() ±ξΉΦ»ή“ΚΧεΜΐΖ÷±πΈΣ
±ξΉΦ»ή“ΚΧεΜΐΖ÷±πΈΣ![]() ΓΔ
ΓΔ![]() ΓΔ
ΓΔ![]() Θ§ΒΎΕΰ¥ΈΈσ≤νΫœ¥σΘ§”Π…α»ΞΘ§‘ρœϊΚΡ±ξΉΦ»ή“ΚΧεΜΐΒΡΤΫΨυ÷ΒΈΣ
Θ§ΒΎΕΰ¥ΈΈσ≤νΫœ¥σΘ§”Π…α»ΞΘ§‘ρœϊΚΡ±ξΉΦ»ή“ΚΧεΜΐΒΡΤΫΨυ÷ΒΈΣ![]() Θ§”…ΘΚ
Θ§”…ΘΚ![]() Θ§Ω…÷Σ
Θ§Ω…÷Σ![]() »ή“Κ÷–
»ή“Κ÷–![]() Θ§Ι 250mLΚ§”–
Θ§Ι 250mLΚ§”–![]() Θ§Ι ≤ζΤΖ÷–»ιΥα―«ΧζΨßΧεΒΡ÷ ΝΩΖ÷ ΐΈΣ
Θ§Ι ≤ζΤΖ÷–»ιΥα―«ΧζΨßΧεΒΡ÷ ΝΩΖ÷ ΐΈΣ![]() ΘΜΙ ¥πΑΗΈΣΘΚ
ΘΜΙ ¥πΑΗΈΣΘΚ ![]() ΓΘ
ΓΘ



| ΡξΦΕ | ΗΏ÷–ΩΈ≥Χ | ΡξΦΕ | ≥θ÷–ΩΈ≥Χ |
| ΗΏ“Μ | ΗΏ“ΜΟβΖ―ΩΈ≥ΧΆΤΦωΘΓ | ≥θ“Μ | ≥θ“ΜΟβΖ―ΩΈ≥ΧΆΤΦωΘΓ |
| ΗΏΕΰ | ΗΏΕΰΟβΖ―ΩΈ≥ΧΆΤΦωΘΓ | ≥θΕΰ | ≥θΕΰΟβΖ―ΩΈ≥ΧΆΤΦωΘΓ |
| ΗΏ»ΐ | ΗΏ»ΐΟβΖ―ΩΈ≥ΧΆΤΦωΘΓ | ≥θ»ΐ | ≥θ»ΐΟβΖ―ΩΈ≥ΧΆΤΦωΘΓ |
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩ÷–ΙζΩΤ―ßΦ“―–ΨΩ≥ωΕ‘ΜΖΨ≥Έέ»Ψ–ΓΓΔ±ψ”Ύ¬ΝΜΊ ’ΒΡΚΘΥ°Βγ≥ΊΘ§ΤδΙΛΉς‘≠άμ Ψ“βΆΦ»γœ¬ΘΚ

œ¬Ν–ΥΒΖ®’ΐ»ΖΒΡ «Θ® Θ©
A.ΒγΦΪΔώΈΣ“θΦΪΘ§ΤδΖ¥”ΠΈΣΘΚO2+4H++4eΘ≠=2H2O
B.Ψέ±ϊœ©ΑκΆΗΡΛ‘ –μ―τάκΉ”¥””“ΆυΉσΆ®Ιΐ
C.»γΙϊΒγΦΪIIΈΣΜν–‘ΟΨ¬ΝΚœΫπΘ§‘ρΗΚΦΪ«χΜα“ί≥ω¥σΝΩΤχΧε
D.Β±ΗΚΦΪ÷ ΝΩΦθ…Ό5.4g ±Θ§’ΐΦΪœϊΚΡ3.36LΤχΧε
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩΙΐΝρΥαΡΤ![]() ≥Θ”ΟΉςΤ·ΑΉΦΝΓΔ―θΜ·ΦΝΒ»ΓΘΡ≥―–ΨΩ–ΓΉιάϊ”Ο»γΆΦΉΑ÷Ο÷Τ±Η
≥Θ”ΟΉςΤ·ΑΉΦΝΓΔ―θΜ·ΦΝΒ»ΓΘΡ≥―–ΨΩ–ΓΉιάϊ”Ο»γΆΦΉΑ÷Ο÷Τ±Η![]() ≤ΔΧΫΨΩΤδ–‘÷
≤ΔΧΫΨΩΤδ–‘÷ ![]() Φ”»»ΦΑΦ–≥÷“«Τς¬‘»Ξ
Φ”»»ΦΑΦ–≥÷“«Τς¬‘»Ξ![]() ΓΘ
ΓΘ
“―÷ΣΘΚ![]()
![]()
![]()
![]()
![]()
![]()
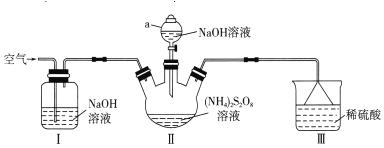
Δ≈“«ΤςaΒΡΟϊ≥Τ «______ΓΘΉΑ÷ΟΔώ÷–NaOH»ή“ΚΒΡΉς”Ο «______ΓΘ
ΔΤΉΑ÷ΟΔρΖΔ…ζΖ¥”ΠΒΡΆ§ ±Θ§–η“Σ≥÷–χΆ®»κΩ’ΤχΒΡΡΩΒΡ «______ΓΘ
Δ«ΉΑ÷ΟΔσΒΡΉς”Ο «______ΓΘ
Δ»![]() »ή“Κ”κΆ≠Ζ¥”Π÷Μ…ζ≥…ΝΫ÷÷―ΈΘ§«“Ζ¥”Πœ»¬ΐΚσΩλΓΘ
»ή“Κ”κΆ≠Ζ¥”Π÷Μ…ζ≥…ΝΫ÷÷―ΈΘ§«“Ζ¥”Πœ»¬ΐΚσΩλΓΘ
ΔΌΗΟΖ¥”ΠΒΡΜ·―ßΖΫ≥Χ ΫΈΣ______ΓΘ
ΔΎΡ≥Ά§―ßΆΤ≤βΖ¥”Πœ»¬ΐΚσΩλΒΡ‘≠“ρΩ…Ρή «…ζ≥…ΒΡ![]() Ε‘Ζ¥”ΠΤπ¥ΏΜ·Ής”ΟΓΘ…ηΦΤ Β―ιΖΫΑΗ―ι÷ΛΗΟΆΤ≤β «Ζώ’ΐ»Ζ______ΓΘ(Ι©―Γ ‘ΦΝΘΚCuΓΔ
Ε‘Ζ¥”ΠΤπ¥ΏΜ·Ής”ΟΓΘ…ηΦΤ Β―ιΖΫΑΗ―ι÷ΛΗΟΆΤ≤β «Ζώ’ΐ»Ζ______ΓΘ(Ι©―Γ ‘ΦΝΘΚCuΓΔ![]() »ή“ΚΓΔ
»ή“ΚΓΔ![]() »ή“ΚΓΔ
»ή“ΚΓΔ![]() »ή“ΚΓΔ’τΝσΥ°)
»ή“ΚΓΔ’τΝσΥ°)
Δ…≤βΕ®≤ζΤΖ¥ΩΕ»ΘΚ≥Τ»Γ![]() ―υΤΖΘ§”Ο’τΝσΥ°»ήΫβΘ§Φ”»κΙΐΝΩKIΘ§≥δΖ÷Ζ¥”ΠΚσΘ§‘ΌΒΈΦ”ΦΗΒΈ÷Η ΨΦΝΘ§”Ο
―υΤΖΘ§”Ο’τΝσΥ°»ήΫβΘ§Φ”»κΙΐΝΩKIΘ§≥δΖ÷Ζ¥”ΠΚσΘ§‘ΌΒΈΦ”ΦΗΒΈ÷Η ΨΦΝΘ§”Ο![]() ±ξΉΦ»ή“ΚΒΈΕ®Θ§¥οΒΫΒΈΕ®÷’Βψ ±Θ§œϊΚΡ±ξΉΦ»ή“ΚΒΡΧεΜΐΈΣ
±ξΉΦ»ή“ΚΒΈΕ®Θ§¥οΒΫΒΈΕ®÷’Βψ ±Θ§œϊΚΡ±ξΉΦ»ή“ΚΒΡΧεΜΐΈΣ![]() ΓΘ(“―÷ΣΘΚ
ΓΘ(“―÷ΣΘΚ![]() )
)
ΔΌ―Γ”ΟΒΡ÷Η ΨΦΝ «______ΘΜ¥οΒΫΒΈΕ®÷’ΒψΒΡœ÷œσ «______ΓΘ
ΔΎ―υΤΖΒΡ¥ΩΕ»ΈΣ______%ΓΘ
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩάύΆΤΥΦΈ§ «Μ·―ßΫβΧβ÷–≥Θ”ΟΒΡ“Μ÷÷ΥΦΈ§ΖΫΖ®Θ§œ¬Ν–”–ΙΊΖ¥”ΠΖΫ≥Χ ΫΘ®ΜράκΉ”ΖΫ≥Χ ΫΘ©ΒΡάύΆΤ’ΐ»ΖΒΡ «Θ®ΓΓΓΓΘ©
“―÷Σ | άύΆΤ | |
A | ΫΪFeΦ”»κCuSO4»ή“Κ÷–ΘΚ Fe + Cu2+ = Cu + Fe2+ | ΫΪNaΦ”»κΒΫCuSO4»ή“Κ÷–ΘΚ 2Na + Cu2+ = Cu + 2Na+ |
B | œΓΝρΥα”κBa(OH)2»ή“ΚΖ¥”Π÷Ν»ή“Κ≥ ÷––‘ΘΚ 2H++SO42©¹+Ba2++2OH©¹=BaSO4Γΐ+2H2O | NaHSO4»ή“Κ”κBa(OH)2»ή“ΚΖ¥”Π≥ ÷––‘ΘΚ 2H++SO42©¹+Ba++2OH©¹=BaSO4Γΐ+2H2O |
C | ΧζΚΆ¬»ΤχΖ¥”Π2Fe+3Cl2 | ΧζΚΆΒΞ÷ Ζ¥”Π2Fe+3I2 |
D | œρCaΘ®ClOΘ©2»ή“Κ÷–Ά®»κ…ΌΝΩCO2ΘΚ Ca2++2ClO©¹+CO2+H2O=CaCO3Γΐ+2HClO | œρCaΘ®ClOΘ©2»ή“Κ÷–Ά®»κ…ΌΝΩSO2ΘΚ Ca2++2ClO©¹+SO2+H2O=CaSO3Γΐ+2HClO |
A.AB.BC.CD.D
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩœ¬Ν–άκΉ”ΖΫ≥Χ Ϋ’ΐ»ΖΒΡ «
A.”Ο![]() ―θΜ·Υα–‘»ή“Κ÷–ΒΡKIΘΚ
―θΜ·Υα–‘»ή“Κ÷–ΒΡKIΘΚ![]()
B.ΡΤ”κΝρΥαΆ≠»ή“ΚΖ¥”ΠΘΚ![]()
C.¥ΉΥα»ή“Κ”κΥ°ΙΗ÷–ΒΡ![]() Ζ¥”ΠΘΚ
Ζ¥”ΠΘΚ![]()
D.ΫΪ…ΌΝΩ![]() Ά®»κNaClO»ή“ΚΘΚ
Ά®»κNaClO»ή“ΚΘΚ![]()
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩ―«œθθΘ¬»![]() «”–ΜζΈοΚœ≥…÷–ΒΡ÷Ί“Σ ‘ΦΝΘ§ΤδΖ–ΒψΈΣ
«”–ΜζΈοΚœ≥…÷–ΒΡ÷Ί“Σ ‘ΦΝΘ§ΤδΖ–ΒψΈΣ![]() Θ§“ΉΥ°ΫβΓΘ“―÷ΣΘΚ
Θ§“ΉΥ°ΫβΓΘ“―÷ΣΘΚ![]() ΈΔ»ή”ΎΥ°Θ§Ρή»ή”ΎœθΥαΘ§
ΈΔ»ή”ΎΥ°Θ§Ρή»ή”ΎœθΥαΘ§![]() Θ§Ρ≥―ßœΑ–ΓΉι‘Ύ Β―ι “”Ο
Θ§Ρ≥―ßœΑ–ΓΉι‘Ύ Β―ι “”Ο![]() ΚΆNO÷Τ±ΗClNO≤Δ≤βΕ®Τδ¥ΩΕ»Θ§œύΙΊ Β―ιΉΑ÷Ο»γΆΦΥυ ΨΓΘ
ΚΆNO÷Τ±ΗClNO≤Δ≤βΕ®Τδ¥ΩΕ»Θ§œύΙΊ Β―ιΉΑ÷Ο»γΆΦΥυ ΨΓΘ
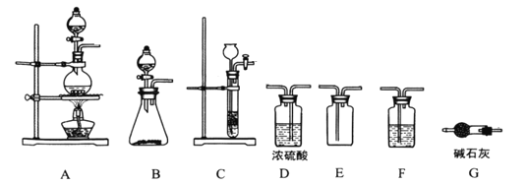
Δ≈÷Τ±Η![]() ΒΡΖΔ…ζΉΑ÷ΟΩ…“‘―Γ”Ο_______(ΧνΉ÷ΡΗ¥ζΚ≈)ΉΑ÷ΟΘ§ΖΔ…ζΖ¥”ΠΒΡάκΉ”ΖΫ≥Χ ΫΈΣ___________ΓΘ
ΒΡΖΔ…ζΉΑ÷ΟΩ…“‘―Γ”Ο_______(ΧνΉ÷ΡΗ¥ζΚ≈)ΉΑ÷ΟΘ§ΖΔ…ζΖ¥”ΠΒΡάκΉ”ΖΫ≥Χ ΫΈΣ___________ΓΘ
ΔΤ”ϊ ’Φ·“ΜΤΩΗ…‘οΒΡ¬»ΤχΘ§―Γ‘ώΚœ ΒΡΉΑ÷ΟΘ§ΤδΝ§Ϋ”Υ≥–ρΈΣ![]() ________________(ΧνΉ÷ΡΗ¥ζΚ≈)ΓΘ
________________(ΧνΉ÷ΡΗ¥ζΚ≈)ΓΘ
Δ« Β―ι “Ω…”ΟΆΦ ΨΉΑ÷Ο÷Τ±Η―«œθθΘ¬»Θ§Φλ―ιΉΑ÷ΟΤχΟή–‘≤ΔΉΑ»κ“©ΤΖΘ§¥ρΩΣ![]() Θ§»ΜΚσ‘Ό¥ρΩΣ
Θ§»ΜΚσ‘Ό¥ρΩΣ![]() Θ§Ά®»κ“ΜΕΈ ±ΦδΤχΧεΘ§ΤδΡΩΒΡ «____________Θ§»ΜΚσΫχ––ΤδΥϊ≤ΌΉςΘ§Β±Z÷–”–“ΜΕ®ΝΩ“ΚΧε…ζ≥… ±Θ§ΆΘ÷Ι Β―ιΓΘ
Θ§Ά®»κ“ΜΕΈ ±ΦδΤχΧεΘ§ΤδΡΩΒΡ «____________Θ§»ΜΚσΫχ––ΤδΥϊ≤ΌΉςΘ§Β±Z÷–”–“ΜΕ®ΝΩ“ΚΧε…ζ≥… ±Θ§ΆΘ÷Ι Β―ιΓΘ
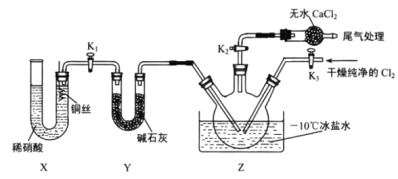
Δ»“―÷ΣΘΚClNOΥ°Ϋβ…ζ≥…![]() –¥≥ωΜ·―ßΖ¥”ΠΖΫ≥Χ Ϋ__________________ΓΘ
–¥≥ωΜ·―ßΖ¥”ΠΖΫ≥Χ Ϋ__________________ΓΘ
ΔΌ”ϊ…ηΦΤ Β―ι÷ΛΟς![]() «»θΥαΘ§–η―Γ‘ώ»γœ¬_____________ ‘ΦΝΩΣ’Ι Β―ι
«»θΥαΘ§–η―Γ‘ώ»γœ¬_____________ ‘ΦΝΩΣ’Ι Β―ι![]() Χν―Γœν
Χν―Γœν![]() ΓΘ
ΓΘ
A. ![]() »ή“Κ B.
»ή“Κ B. ![]() »ή“Κ C. Κλ…Ϊ ·»ο ‘÷Ϋ D. άΕ…Ϊ ·»ο ‘÷Ϋ
»ή“Κ C. Κλ…Ϊ ·»ο ‘÷Ϋ D. άΕ…Ϊ ·»ο ‘÷Ϋ
![]() “―÷Σœ¬Ν–Έο÷ ‘Ύ≥ΘΈ¬œ¬ΒΡ
“―÷Σœ¬Ν–Έο÷ ‘Ύ≥ΘΈ¬œ¬ΒΡ![]() »γΆΦΘΚ
»γΆΦΘΚ
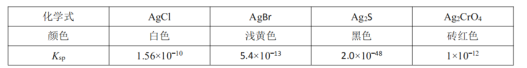
Ά®Ιΐ“‘œ¬ Β―ι≤βΕ®ClNO―υΤΖΒΡ¥ΩΕ»ΓΘ»ΓZ÷–ΥυΒΟ“ΚΧε![]() »ή”ΎΥ°Θ§≈δ÷Τ≥…
»ή”ΎΥ°Θ§≈δ÷Τ≥…![]() »ή“ΚΘΜ»Γ≥ω
»ή“ΚΘΜ»Γ≥ω![]() ―υΤΖ»ή”ΎΉΕ–ΈΤΩ÷–Θ§”Ο
―υΤΖ»ή”ΎΉΕ–ΈΤΩ÷–Θ§”Ο![]() ±ξΉΦ»ή“ΚΒΈΕ®÷Ν÷’ΒψΘ§”ΠΦ”»κΒΡ÷Η ΨΦΝ «_______________ΓΘ
±ξΉΦ»ή“ΚΒΈΕ®÷Ν÷’ΒψΘ§”ΠΦ”»κΒΡ÷Η ΨΦΝ «_______________ΓΘ
A.![]() B.
B. ![]() C.
C. ![]() D.
D. ![]()
œϊΚΡ±ξΉΦ»ή“ΚΒΡΧεΜΐΈΣ![]() Θ§ΒΈΕ®÷’ΒψΒΡœ÷œσ « ________________Θ§―«œθθΘ¬»
Θ§ΒΈΕ®÷’ΒψΒΡœ÷œσ « ________________Θ§―«œθθΘ¬»![]() ΒΡ÷ ΝΩΖ÷ ΐΈΣ________ΓΘ
ΒΡ÷ ΝΩΖ÷ ΐΈΣ________ΓΘ
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩΩ…ΡφΖ¥”ΠmAΘ®ΙΧΘ©+nBΘ®ΤχΘ©![]() pCΘ®ΤχΘ©+qDΘ®ΤχΘ©Θ§Ζ¥”ΠΙΐ≥Χ÷–ΤδΥϋΧθΦΰ≤Μ±δ ±CΒΡΑΌΖ÷Κ§ΝΩC%”κΈ¬Ε»Θ®TΘ©ΚΆ―Ι«ΩΘ®PΘ©ΒΡΙΊœΒ»γΆΦΥυ ΨΘ§œ¬Ν––π ω÷–’ΐ»ΖΒΡ «
pCΘ®ΤχΘ©+qDΘ®ΤχΘ©Θ§Ζ¥”ΠΙΐ≥Χ÷–ΤδΥϋΧθΦΰ≤Μ±δ ±CΒΡΑΌΖ÷Κ§ΝΩC%”κΈ¬Ε»Θ®TΘ©ΚΆ―Ι«ΩΘ®PΘ©ΒΡΙΊœΒ»γΆΦΥυ ΨΘ§œ¬Ν––π ω÷–’ΐ»ΖΒΡ «
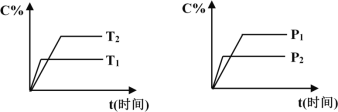
A. ¥οΒΫΤΫΚβΚσΘ§ Ι”Ο¥ΏΜ·ΦΝΘ§C%ΫΪ‘ω¥σ
B. ¥οΒΫΤΫΚβΚσΘ§»τ…ΐΗΏΈ¬Ε»ΓΔΜ·―ßΤΫΚβœρΡφΖ¥”ΠΖΫœρ“ΤΕ·
C. ΖΫ≥Χ Ϋ÷–n>p+q
D. ¥οΒΫΤΫΚβΚσΘ§‘ωΦ”AΒΡΝΩ”–άϊ”ΎΜ·―ßΤΫΚβœρ’ΐΖ¥”ΠΖΫœρ“ΤΕ·
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩClO2 «“Μ÷÷ΜΤ¬Χ…ΪΜρ≥»ΜΤ…ΪΒΡΤχΧεΘ§ΦΪ“Ή»ή”ΎΥ°Θ§Ω…”Ο”ΎΥ°ΒΡœϊΕΨ…±ΨζΓΔΥ°Χε÷–Mn2+Β»÷ΊΫπ τ«ε≥ΐΦΑ―ΧΤχΒΡΆ―ΝρΆ―œθΓΘΜΊ¥πœ¬Ν–Έ ΧβΘΚ
(1)ΫΪΙΐΝρΥαΡΤ(Na2S2O8)»ή“ΚΦ”»κ―«¬»ΥαΡΤ(NaClO2)÷–Ω…÷Τ±ΗClO2Θ§ΗΟΖ¥”Π÷–―θΜ·ΦΝΚΆΜΙ‘≠ΦΝΒΡΈο÷ ΒΡΝΩ÷°±»ΈΣ_____ΓΘ
(2)ΫΪClO2Ά®»κMnSO4»ή“ΚΘ§»ή“Κ÷–Ω…Φλ≤βΒΫCl-Ά§ ±”–ΚΎ…Ϊ≥ΝΒμ…ζ≥…ΓΘΗΟΖ¥”ΠΒΡάκΉ”ΖΫ≥Χ ΫΈΣ__________ΓΘ
(3)ΈΣ―–ΨΩClO2Ά―œθΒΡ “ΥΧθΦΰΘ§‘Ύ1L200 mgL-1 ClO2»ή“Κ÷–Φ”NaOH»ή“ΚΒςΫΎpHΘ§Ά®»κNOΤχΧε≤Δ≤βΕ®NOΒΡ»Ξ≥ΐ¬ Θ§Ά―œθΚσN‘ΣΥΊ“‘NO3Θ≠–Έ Ϋ¥φ‘ΎΘ§ΤδΙΊœΒ»γœ¬ΆΦΥυ ΨΘΚ
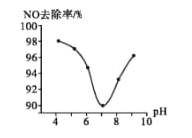
ΔΌ Β―ι÷– Ι”ΟΒΡClO2»ή“ΚΒΡΈο÷ ΒΡΝΩ≈®Ε»ΈΣ______(±ΘΝτ»ΐΈΜ”––ß ΐΉ÷Θ©ΘΜ“Σ ΙNOΒΡ»Ξ≥ΐ¬ ΗϋΗΏΘ§”ΠΩΊ÷ΤΒΡΧθΦΰ «_________ΓΘ
ΔΎΒ±»ή“ΚpHΘΨ7 ±Θ§NOΒΡ»Ξ≥ΐ¬ ‘ω¥σΒΡ‘≠“ρ «ClO2”κNaOH»ή“ΚΖ¥”ΠΩ……ζ≥…Ηϋ«ΩΒΡΈϋ ’ΦΝNaClO2Θ§–¥≥ωΦν–‘ΧθΦΰœ¬NaClO2Ά―≥ΐNOΖ¥”ΠΒΡάκΉ”ΖΫ≥Χ ΫΘΚ_________ΓΘ
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩΙΛ“Β…œάϊ”Ο»μΟΧΩσΘ®÷ς“Σ≥…Ζ÷ΈΣMnO2Θ§Ά§ ±Κ§…ΌΝΩΧζΓΔ¬ΝΒ»ΒΡΜ·ΚœΈοΘ©÷Τ±ΗΝρΥαΟΧΒΡ≥ΘΦϊΝς≥Χ»γœ¬ΘΚ
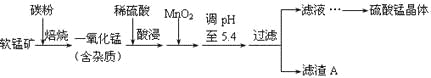
≤ΩΖ÷Ϋπ τ―τάκΉ”“‘«β―θΜ·Έο–Έ ΫΆξ»Ϊ≥ΝΒμ ±»ή“ΚΒΡpHΦϊœ¬±μΘΚ
≥ΝΒμΈο | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Mn(OH)2 |
pH | 5.2 | 3.2 | 9.7 | 10.4 |
Θ®1Θ©“Μ―θΜ·ΟΧ”ΟΝρΥαΥαΫΰ ±ΖΔ…ζΒΡ÷ς“ΣΖ¥”ΠΒΡάκΉ”ΖΫ≥Χ ΫΈΣ____________________ΓΘΥαΫΰΚσΦ”»κMnO2ΫΪ»ή“Κ÷–ΒΡFe2ΘΪ―θΜ·≥…Fe3ΘΪΘ§ΤδΡΩΒΡ «___________ΓΘ
Θ®2Θ©¬Υ‘ϋAΒΡ≥…Ζ÷≥ΐMnO2ΆβΘ§ΜΙ”–_______________ΓΘ
Θ®3Θ©MnO2 «÷Τ‘λΦν–‘–ΩΟΧΒγ≥ΊΒΡΜυ±Ψ‘≠ΝœΘ§Ζ≈Βγ ±ΗΚΦΪΒΡΒγΦΪΖ¥”Π ΫΈΣ________ΓΘΙΛ“Β…œ“‘ ·ΡΪΈΣΒγΦΪΒγΫβΥαΜ·ΒΡMnSO4»ή“Κ…ζ≤ζMnO2Θ§―τΦΪΒΡΒγΦΪΖ¥”Π ΫΈΣ_________Θ§Β±“θΦΪ≤ζ…ζ4.48LΘ®±ξΩωΘ©ΤχΧε ±Θ§MnO2ΒΡάμ¬έ≤ζΝΩΈΣ______gΓΘ
Θ®4Θ©ΟΧΒΡ»ΐ÷÷Ρ―»ήΜ·ΚœΈοΒΡ»ήΕ»ΜΐΘΚKsp(MnCO3)ΘΫ1.8ΓΝ10Θ≠11Θ§Ksp[Mn(OH)2]ΘΫ1.9ΓΝ10Θ≠13Θ§Ksp(MnS)ΘΫ2.0ΓΝ10Θ≠13Θ§‘ρ…œ ω»ΐ÷÷Ρ―»ήΈοΒΡ±ΞΚΆ»ή“Κ÷–Θ§Mn2ΘΪ≈®Ε»”…¥σΒΫ–ΓΒΡΥ≥–ρ «_______ΘΨ_______ΘΨ_______Θ®Χν–¥Μ·―ß ΫΘ©ΓΘ
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΙζΦ ―ß–Θ”≈―Γ - ΝΖœΑ≤αΝ–±μ - ‘ΧβΝ–±μ
Κΰ±± ΓΜΞΝΣΆχΈΞΖ®ΚΆ≤ΜΝΦ–≈œΔΨΌ±®ΤΫΧ® | Άχ…œ”–ΚΠ–≈œΔΨΌ±®Ή®«χ | Βγ–≈’©Τ≠ΨΌ±®Ή®«χ | …φάζ Ζ–ιΈό÷ς“ε”–ΚΠ–≈œΔΨΌ±®Ή®«χ | …φΤσ«÷»®ΨΌ±®Ή®«χ
ΈΞΖ®ΚΆ≤ΜΝΦ–≈œΔΨΌ±®ΒγΜΑΘΚ027-86699610 ΨΌ±®” œδΘΚ58377363@163.com