
【题目】中国科学家研究出对环境污染小、便于铝回收的海水电池,其工作原理示意图如下:

下列说法正确的是( )
A.电极Ⅰ为阴极,其反应为:O2+4H++4e-=2H2O
B.聚丙烯半透膜允许阳离子从右往左通过
C.如果电极II为活性镁铝合金,则负极区会逸出大量气体
D.当负极质量减少5.4g时,正极消耗3.36L气体
 小学课时特训系列答案
小学课时特训系列答案科目:高中化学 来源: 题型:
【题目】用H2O2、KI和洗洁精可完成“大象牙膏”实验(短时间内产生大量泡沫),某同学依据文献资料对该实验进行探究。
(1)资料1:KI在该反应中的作用:H2O2 + I![]() = H2O + IO
= H2O + IO![]() ;H2O2 + IO
;H2O2 + IO![]() = H2O + O2↑+ I
= H2O + O2↑+ I![]() 。总反应的化学方程式是_______________________________________________。
。总反应的化学方程式是_______________________________________________。
(2)资料2:H2O2分解反应过程中能量变化如图所示,其中①有KI加入,②无KI加入。下列判断正确的是______(填字母)。
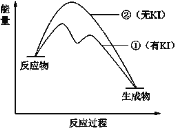
a.加入KI后改变了反应的路径
b.加入KI后改变了总反应的能量变化
c.H2O2 + I![]() = H2O + IO
= H2O + IO![]() 是放热反应
是放热反应
(3)实验中发现,H2O2与KI溶液混合后,产生大量气泡,溶液颜色变黄。再加入CCl4,振荡、静置,气泡明显减少。
资料3:I2也可催化H2O2的分解反应。
① 加CCl4并振荡、静置后还可观察到___________________________________,说明有I2生成。
② 气泡明显减少的原因可能是:
ⅰ. H2O2浓度降低;
ⅱ._________________________________________。
以下对照实验说明ⅰ不是主要原因:向H2O2溶液中加入KI溶液,待溶液变黄后,分成两等份于A、B两试管中。A试管加入CCl4,B试管不加CCl4,分别振荡、静置。观察到的现象是________________________。
(4)资料4:I![]() + I
+ I![]()
![]() I
I![]() K= 640。
K= 640。
为了探究体系中含碘微粒的存在形式,进行实验:向20 mL一定浓度的H2O2溶液中加入10 mL 0.10 mol·L-1 KI溶液,达平衡后,相关微粒浓度如下:
微粒 | I | I | I |
浓度/ (mol·L-1) | 2.5×10-3 | a | 4.0×10-3 |
① a =____________________。
② 该平衡体系中除了含有I![]() 、I
、I![]() 和I
和I![]() 外,一定还含有其他含碘微粒,理由是_____________________。
外,一定还含有其他含碘微粒,理由是_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W是原子序数依次增大的四种短周期元素。Y和Z位于同一周期,可组成中学常见的共价化合物YZ和YZ2,X和Z最外层电子数之和与W的最外层电子数相同,25℃0.01mol·L-1 X和W形成化合物的水溶液pH为2,下列说法正确的是
A. Y元素的非金属性大于W元素
B. X和Y可以形成既含极性键又含非极性键的分子
C. YZ和YZ2均可以被NaOH溶液直接吸收
D. X和W形成的化合物中各原子均为8电子稳定结构
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2 L密闭容器中发生反应4A(s)+3B(g)=2C(g)+D(g),经2 min,B的物质的量减少0.6 mol,下列对该反应速率表示正确的是
A.用B表示的反应速率:v (B)=0.3 mol·L-1·min-1
B.分别用B、C表示的反应速率其比值为2∶3
C.用D表示的平均反应速率为:v (D)= 0.05 mol·L-1·min-1
D.用A表示的反应速率为:v (A)=0.4 mol·L-1·min-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在如图所示的铜锌原电池中,以硫酸为电解质溶液,
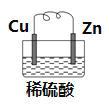
(1)锌为___极,电极上发生的是__反应(填“氧化”或“还原”),电极反应式为___。
(2)铜为___极,电极上发生的是__反应(填“氧化”或“还原”),电极反应式是__;原电池总反应的离子方程式为__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】消除含氮化合物对大气和水体的污染是环境保护的重要研究课题。
(1)已知:N2(g)+O2(g)=2NO(g) ΔH=a kJ·mol-1
2NO(g)+O2(g)=2NO2(g) ΔH=b kJ·mol-1
4NH3(g)+5O2(g)=4NO(g)+6H2O(l) ΔH=c kJ·mol-1
则常温常压下,NH3与NO2反应生成无污染物质的热化学方程式_____________。
(2)水体中过量氨氮(以NH3表示)会导致水体富营养化。
①用次氯酸钠除去氨氮的原理如图所示:
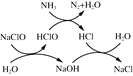
写出该图示的总反应化学方程式:__________________。该反应需控制温度,温度过高时氨氮去除率降低的主要原因是______________。
②取一定量的含氨氮废水,改变加入次氯酸钠的用量,反应一段时间后,溶液中氨氮去除率、总氮(溶液中所有可溶性的含氮化合物中氮元素的总量)去除率以及剩余次氯酸钠的含量随m(NaClO)∶m(NH3)的变化情况如图所示:
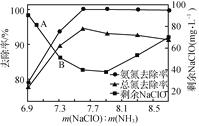
当m(NaClO)∶m(NH3)>7.6时,水体中总氮去除率反而下降,可能的原因是___。
(3)电极生物膜电解脱硝是电化学和微生物工艺的组合。某微生物膜能利用电解产生的活性原子将NO3-还原为N2,工作原理如图所示:
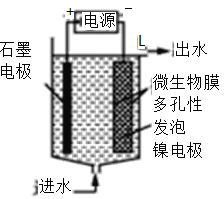
①写出该活性原子与NO3-反应的离子方程式:________________。
②若阳极生成标准状况下2.24 L气体,理论上可除去NO3-的物质的量为____mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯仿![]() 常因保存不慎而被氧化,产生剧毒物光气
常因保存不慎而被氧化,产生剧毒物光气![]() :
:![]() ,下列说法不正确的有
,下列说法不正确的有![]()
![]()

A. ![]() 分子为含极性键的非极性分子
分子为含极性键的非极性分子
B. ![]() 分子中含有3个
分子中含有3个![]() 键、一个
键、一个![]() 键,中心C原子采用
键,中心C原子采用![]() 杂化
杂化
C. ![]() 分子中所有原子的最外层电子都满足8电子稳定结构
分子中所有原子的最外层电子都满足8电子稳定结构
D. 使用前可用硝酸银稀溶液检验氯仿是否变质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】列关于古籍中的记载说法正确的是( )
A.直径为20 nm的纳米碳酸钙属于胶体
B.氢化钙的电子式是:Ca2+[∶H]2-
C.“千锤万凿出深山,烈火焚烧若等闲。”这句古诗包含了吸热反应过程
D.《本草经集注》中关于鉴别硝石(KNO3)和朴硝(Na2SO4)的记载:“以火烧之,紫青烟起,乃真硝石也”,该方法应用了显色反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乳酸亚铁晶体![]() 是一种很好的食品铁强化剂,易溶于水,吸收效果比无机铁好,可由乳酸与
是一种很好的食品铁强化剂,易溶于水,吸收效果比无机铁好,可由乳酸与![]() 反应制得:
反应制得:![]() 。
。
I. 制备![]() :装置如下图所示:
:装置如下图所示:
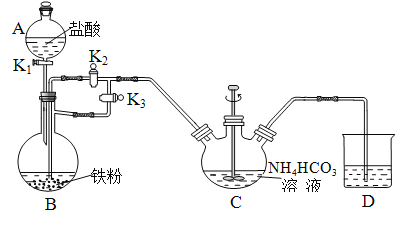
⑴B的名称是________________。
⑵①清洗仪器,检查装置的气密性。
②实验操作:在A中加入盐酸,B中加入铁粉、C中加入![]() 溶液。关闭活塞______(填
溶液。关闭活塞______(填![]() 或
或![]() ,下同)打开活塞______,滴入足量盐酸后,关闭活塞
,下同)打开活塞______,滴入足量盐酸后,关闭活塞![]() ,开动搅拌器,反应一段时间后关闭活塞______、打开活塞_______。
,开动搅拌器,反应一段时间后关闭活塞______、打开活塞_______。
C中发生的反应的离子方程式为_______________________________________。
Ⅱ.制备乳酸亚铁晶体:将制得的![]() 加入乳酸溶液中,加入少量铁粉,在
加入乳酸溶液中,加入少量铁粉,在![]() 下搅拌使之充分反应。然后再加入适量乳酸。
下搅拌使之充分反应。然后再加入适量乳酸。
⑶加入少量铁粉的作用是___________________________________。从所得溶液中获得乳酸亚铁晶体所需的实验操作是:隔绝空气低温蒸发,冷却结晶,______、______、干燥。
Ⅲ.乳酸亚铁晶体纯度的测量:
⑷若用![]() 滴定法测定样品中
滴定法测定样品中![]() 的量进而计算纯度时,发现结果总是大于
的量进而计算纯度时,发现结果总是大于![]() ,其原因可能是_________________________。
,其原因可能是_________________________。
⑸经查阅文献后,改用![]() 标准溶液滴定进行测定。反应中
标准溶液滴定进行测定。反应中![]() 离子的还原产物为
离子的还原产物为![]() 。测定时,先称取
。测定时,先称取![]() 样品溶解后进行必要处理,配制成250mL溶液,每次取
样品溶解后进行必要处理,配制成250mL溶液,每次取![]() ,用
,用![]() 标准溶液滴定至终点,记录数据如右表。则产品中乳酸亚铁晶体的纯度为:____________
标准溶液滴定至终点,记录数据如右表。则产品中乳酸亚铁晶体的纯度为:____________![]() 以质量分数表示,乳酸亚铁式量为
以质量分数表示,乳酸亚铁式量为![]() 。
。
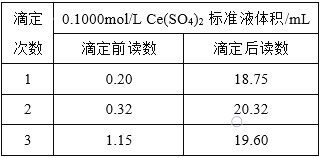
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com