
【题目】用H2O2、KI和洗洁精可完成“大象牙膏”实验(短时间内产生大量泡沫),某同学依据文献资料对该实验进行探究。
(1)资料1:KI在该反应中的作用:H2O2 + I![]() = H2O + IO
= H2O + IO![]() ;H2O2 + IO
;H2O2 + IO![]() = H2O + O2↑+ I
= H2O + O2↑+ I![]() 。总反应的化学方程式是_______________________________________________。
。总反应的化学方程式是_______________________________________________。
(2)资料2:H2O2分解反应过程中能量变化如图所示,其中①有KI加入,②无KI加入。下列判断正确的是______(填字母)。
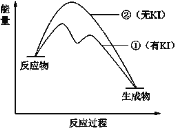
a.加入KI后改变了反应的路径
b.加入KI后改变了总反应的能量变化
c.H2O2 + I![]() = H2O + IO
= H2O + IO![]() 是放热反应
是放热反应
(3)实验中发现,H2O2与KI溶液混合后,产生大量气泡,溶液颜色变黄。再加入CCl4,振荡、静置,气泡明显减少。
资料3:I2也可催化H2O2的分解反应。
① 加CCl4并振荡、静置后还可观察到___________________________________,说明有I2生成。
② 气泡明显减少的原因可能是:
ⅰ. H2O2浓度降低;
ⅱ._________________________________________。
以下对照实验说明ⅰ不是主要原因:向H2O2溶液中加入KI溶液,待溶液变黄后,分成两等份于A、B两试管中。A试管加入CCl4,B试管不加CCl4,分别振荡、静置。观察到的现象是________________________。
(4)资料4:I![]() + I
+ I![]()
![]() I
I![]() K= 640。
K= 640。
为了探究体系中含碘微粒的存在形式,进行实验:向20 mL一定浓度的H2O2溶液中加入10 mL 0.10 mol·L-1 KI溶液,达平衡后,相关微粒浓度如下:
微粒 | I | I | I |
浓度/ (mol·L-1) | 2.5×10-3 | a | 4.0×10-3 |
① a =____________________。
② 该平衡体系中除了含有I![]() 、I
、I![]() 和I
和I![]() 外,一定还含有其他含碘微粒,理由是_____________________。
外,一定还含有其他含碘微粒,理由是_____________________。
【答案】2H2O2 = 2H2O+O2↑ a 下层溶液呈紫红色 在水溶液中I2的浓度降低 B试管中产生气泡速率没有明显减小 2.5×10-3 2c(I2) + c(I -) + 3c(I3-)<0.033 mol·L-1
【解析】
(1)将两个反应叠加;
(2)![]() 起催化剂作用;
起催化剂作用;
(3)①四氯化碳萃取碘;
②气泡明显减少的原因也可能是碘的浓度降低;做对比实验;
(4)①根据平衡常数进行计算;
②根据元素守恒判断。
(1)将两个反应叠加得到:![]() ,
,
故答案为:![]() ;
;
(2)a.![]() 起催化剂作用,加入催化剂改变了反应历程,从而降低活化能,a正确;
起催化剂作用,加入催化剂改变了反应历程,从而降低活化能,a正确;
b.根据盖斯定律,总反应的能量变化不变,b错误;
c.![]() 是前半段反应,根据图像该反应是吸热反应,c错误;
是前半段反应,根据图像该反应是吸热反应,c错误;
答案选a。
(3)①碘易溶于四氯化碳,且四氯化碳密度大于水,与水分层在下层, 碘进入下层的四氯化碳中显紫红色,
故答案为:下层溶液呈紫红色;
②气泡明显减少的原因也可能是碘的浓度降低;做对比实验,ⅰ不是主要原因,则说明不加四氯化碳反应速率变化不大,
故答案为:在水溶液中I2的浓度降低;B试管中产生气泡速率没有明显减小;
(4)①根据平衡常数进行计算,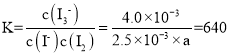 ,解得a= 2.5×10-3,
,解得a= 2.5×10-3,
故答案为:2.5×10-3;
②根据元素守恒判断,![]() 与
与![]() 对比,
对比,
故答案为:![]() 。
。


 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案科目:高中化学 来源: 题型:
【题目】X、Y两根金属棒插入Z溶液中构成如图的装置,实验中电流表指针发生偏转,同时X棒变粗,Y棒变细,则X、Y、Z可能是( )
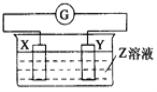
选项 | X | Y | Z |
A | Zn | Cu | 稀硫酸 |
B | Cu | Zn | 稀硫酸 |
C | Cu | Ag | 硫酸铜溶液 |
D | Ag | Zn | 硝酸银溶液 |
A.AB. BC. CD. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上制汞的过程是:焙烧辰砂(主要含HgS),发生反应:HgS+O2![]() Hg+SO2还原出的汞呈气态,冷凝得液态汞。其流程如图,下列说法不正确的是
Hg+SO2还原出的汞呈气态,冷凝得液态汞。其流程如图,下列说法不正确的是
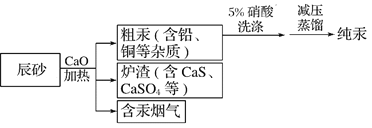
A. 洗涤粗汞时可用5%的盐酸代替5%的硝酸
B. HgS+O2![]() Hg+SO2属于置换反应
Hg+SO2属于置换反应
C. 含汞烟气必须处理达标后才能排放
D. 流程中加入氧化钙的目的是减少SO2的排放
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可用于检测CO的某气敏传感器的工作原理如图所示。下列说法不正确的是

A.工作过程中化学能转化为电能
B.工作一段时间后溶液的pH几乎不变
C.电极I上发生反应:CO - 2e- + H2O = CO2 + 2H+
D.电极II上发生反应:O2 + 2H2O + 4e- = 4OH![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将2 mol SO2和2 mol SO3气体混合于某固定体积的密闭容器中,在一定条件下反应:2SO2(g)+O2(g)![]() 2SO3(g),平衡时SO3为W mol。相同温度下,分别按下列配比在相同体积的容器中反应,反应达到平衡时,SO3的物质的量大于W mol的是( )
2SO3(g),平衡时SO3为W mol。相同温度下,分别按下列配比在相同体积的容器中反应,反应达到平衡时,SO3的物质的量大于W mol的是( )
A.2 mol SO2+1 mol O2B.4 mol SO2+1 mol O2
C.2 mol SO2+1 mol O2+2 mol SO3D.3 mol SO2+1 mol SO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以镍废料(主要成分为镍铁合金,含少量铜)为原料,生产NiO的部分工艺流程如下:
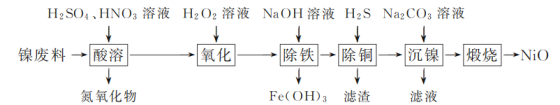
已知:下表列出了几种金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0 mol·L-1计算)。
氢氧化物 | Fe(OH)3 | Fe(OH)2 | Ni(OH)2 |
开始沉淀的pH | 1.5 | 6.5 | 7.7 |
沉淀完全的pH | 3.3 | 9.9 | 9.2 |
(1) “酸溶”时Ni转化为NiSO4,该过程中温度控制在70~80 ℃的原因是________。
(2) “氧化”时,Fe2+参加反应的离子方程式为________。
(3) “除铁”时需控制溶液的pH范围为________。
(4) “滤渣”的主要成分为________(填化学式)。
(5) “沉镍”时得到碱式碳酸镍[用xNiCO3·yNi(OH)2表示]沉淀。
①在隔绝空气条件下,“煅烧”碱式碳酸镍得到NiO,该反应的化学方程式为________。
②“沉镍”时,溶液pH增大,碱式碳酸镍中Ni元素含量会增加,原因是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】绿色化学是预防污染的根本手段,它的目标是研究和寻找能充分利用的无毒害原材料,最大限度地节约能源,在化工生产各个环节中都实现净化和无污染。
(1)下列各项符合“绿色化学”要求的是________(填序号)。
A.处理废弃物 B.治理污染点 C.减少有毒物 D.杜绝污染源
(2)某化工厂排放的污水中含有![]() 、
、![]() 、
、![]() 、
、![]() 四种离子。某同学设计了从该污水中回收金属铜的方案。
四种离子。某同学设计了从该污水中回收金属铜的方案。
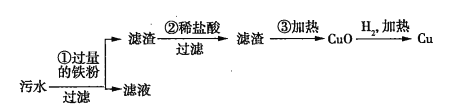
在回收金属铜的方案中,操作_______会导致环境污染,为防止污染,应采取的措施是_______________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)链烃A其相对分子质量在65-75之间,1molA完全燃烧消耗7.5mol氧气,则A的结构有_______种。
(2)有机物B,俗名水杨酸,其结构简式为 ,将B跟一种溶液C(足量)反应可得到一种钠盐(其化学式为C7H5O3Na),则C的化学式为_______,水杨酸的同分异构体中,属于酚类,但不属于酯类,也不属于羧酸类的化合物中必定含有_______(填写除了羟基以外的官能团名称)
,将B跟一种溶液C(足量)反应可得到一种钠盐(其化学式为C7H5O3Na),则C的化学式为_______,水杨酸的同分异构体中,属于酚类,但不属于酯类,也不属于羧酸类的化合物中必定含有_______(填写除了羟基以外的官能团名称)
(3)化合物![]() ,涂于手术创口表面,在数秒内发生固化,并起黏结作用(因发生反应生成高分子化合物),可代替通常伤口的缝合线,该高分子化合物的结构简式为_______。
,涂于手术创口表面,在数秒内发生固化,并起黏结作用(因发生反应生成高分子化合物),可代替通常伤口的缝合线,该高分子化合物的结构简式为_______。
(4)最近研制成一种新型聚乳酸酯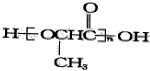 ,能取代苯乙烯塑料,以消除“白色污染”,净化环境,它的单体结构简式为_______。
,能取代苯乙烯塑料,以消除“白色污染”,净化环境,它的单体结构简式为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中国科学家研究出对环境污染小、便于铝回收的海水电池,其工作原理示意图如下:

下列说法正确的是( )
A.电极Ⅰ为阴极,其反应为:O2+4H++4e-=2H2O
B.聚丙烯半透膜允许阳离子从右往左通过
C.如果电极II为活性镁铝合金,则负极区会逸出大量气体
D.当负极质量减少5.4g时,正极消耗3.36L气体
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com