
【题目】乙烯的产量可用来衡量一个国家的石油化工发展水平。下列关于乙烯的说法正确的是
A.与苯互为同分异构体
B.分子中存在碳碳双键
C.能使溴的四氯化碳溶液褪色
D.能使酸性高锰酸钾溶液褪色
科目:高中化学 来源: 题型:
【题目】下列反应一定属于放热反应的是( )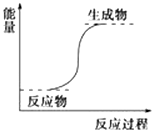
A.氢氧化钡晶体和氯化铵晶体的反应
B.能量变化如图所示的反应
C.化学键断裂吸收的能量比化学键形成放出的能量少的反应
D.不需要加热就能发生的反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中错误的是( )
A.含有共价键的化合物一定是共价化合物
B.在共价化合物中一定含有共价键
C.含有离子键的化合物一定是离子化合物
D.离子化合物中可能含有共价键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是元素周期表的一部分,表中所列字母a、b、c、d、e、f、g、h分别代表某种化学元素。请依据这8种元素回答下列问题。

(1)上述8种元素的单质中常温下为气态,且密度最小的是______(填化学式)。
(2)f元素的原子结构示意图为_______。
(3)c的最高价氧化物对应水化物的化学式为______。
(4)hg的电子式为_______。
(5)b、c、d三种元素的最简单氢化物的沸点由高到低的顺序是______(填化学式)。
(6)元素e的单质与h的最高价氧化物对应的水化物反应的化学方程式为__________。
(7)f元素的最简单氢化物的水溶液显____性(填“酸”或“碱”),请写出该氢化物久置在空气中变质的化学方程式________。
(8)gd-常用作消毒剂,单质砷(As)在碱性溶液中可被gd-氧化为AsO43-,该反应的离子方程式为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物X的结构简式如图所示,则下列有关说法中不正确的是( ) 
A.能发生加成、取代、氧化反应
B.1 mol该物质最多可与7mol NaOH反应
C.1 mol该物质最多可与6 mol H2反应
D.能与FeCl3溶液发生显色反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z都是金属,把X浸入Z的硝酸盐溶液中,X的表面有Z析出,X和Y组成原电池时,Y为电池的负极.X、Y、Z三种金属的活动性顺序为( )
A.X>Y>Z
B.X>Z>Y
C.Y>X>Z
D.Y>Z>X
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有如下描述
①冰的密度小于水,液态水中含有(H2O)n都是由于氢键所致
②不同种元素组成的多原子分子里的键一定都是极性键
③离子键就是阳离子、阴离子的相互引力
④用电子式表示MgCl2的形成过程:![]()
⑤H2分子和Cl2分子的反应过程就是H2、Cl2分子里的共价键发生断裂生成H原子、Cl原子,而后H原子、Cl原子形成离子键的过程
上述说法正确的是( )
A. ①②③④⑤ B. ①② C. ④ D. ①
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家提出“绿色自由”构想,把空气中的CO2转化为可再生能源甲醇(CH3OH).该反应的热化学方程式为:CO(g)+2H2(g)→CH3OH(g)+H2O(g)△H
(1)若在一个定温定容的容器中发生上述反应,反应达到平衡的标志是 .
A.CO2和CH3OH的浓度相等
B.H2的百分含量保持不变
C.容器内压强保持不变
D.3v正(H2)=v逆(H2O)
E.容器中混合气体的密度保持不变
(2)若将CO2和H2的混合气体分成五等份,将它们分别充入温度不同、容积相同的恒容容器中发生上述反应.反应相同时间后,测得甲醇的体积分数 (CH3OH)与反应温度T的关系如图1,则上述CO2转化为甲醇的反应的△H0(填“>”、“<”、“=”) 
(3)上述反应在实际生产中采用的温度是300℃,其目的是 .
(4)300℃时,将CO2与H2按1:3的体积比充入某密闭容器中,CO2的平衡转化率(a)与体系总压强(P)的关系如图2所示.回答问题: ①若其他条件不变,将A点的体积压缩至原来的一半,一段时间后反应再次达到平衡,与原平衡相比较下列说法正确的是 .
A.CO2的浓度减小
B.正反应速率增大,逆反应速率减小
C.CO2和H2的体积比仍然是1:3
D.H2的体积分数减小②B点平衡混合气体的平均摩尔质量为 22.7g/mol (保留一位小数).
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com