
����Ŀ������ͼ1��ʾװ�ý�������ˮ������Ӧ��ʵ�飮 
��1��������ˮ������Ӧ�Ļ�ѧ����ʽ�ǣ���
��2��Ϊ�������ɵ������������ͼѡ���Ҫ��װ�ã�����ȷ������˳��Ϊ���ýӿ���ĸ��ʾ��a�� fgbch �� ��������֤��������ʵ�������� 
��3��ֹͣ��Ӧ����װ����ȴ��ȡ����Ӧ�������ۻ������������ϡ�����ַ�Ӧ�����ˣ���������������Һ��Fe3+�IJ�����������
��4��������������Һ�в���Fe3+ �� �ⲻ��˵��������ˮ������Ӧ���ò����в���+3�۵�����ԭ���ǣ������ӷ���ʽ˵��������
��5��ijͬѧ����������Һ��ȡ��ɫ��Fe��OH��2����������Һ�м���NaOH��Һ�۲쵽���ɵİ�ɫ����Ѹ�ٱ�ɻ���ɫ������ɺ��ɫ��
�ٳ����ɰ�ɫ��Ϊ���ɫ�Ļ�ѧ����ʽ�ǣ���
��Ϊ�˵õ���ɫ��Fe��OH��2��������������ʹ������ʱ�䱣�ְ�ɫ����ͬѧ�����ͼ2��ʾ��װ�ã�ͨ�����Һ�в��������İ�ɫ�������ҽϳ�ʱ�䲻��ɫ������˵������ȷ����������ţ���
A����Դ�е�aΪ������bΪ����
B��������NaCl��Һ��Ϊ���Һ
C��A��B���˶������������缫
D�����������ķ�Ӧ��2H++2e���TH2��
���𰸡�
��1��Fe+4H2O��g�� ![]() Fe3O4+4H2
Fe3O4+4H2
��2����ɫ������ͭ��ɺ�ɫ����ɫ����ˮ����ͭ�����ɫ
��3��ȡ������Һ���Թ��У����뼸��KSCN��Һ������Һ��Ѫ��ɫ��֤�����������ӣ�������������
��4�������Ӧ��Ļ�����к��й��������ۣ��ᷢ����Ӧ2Fe3++Fe=3Fe2+ �� ���۰�������ȫ����ԭΪ�������Ӻ����KSCN��Һ�����ɫ
��5��4Fe��OH��2+O2+2H2O=4Fe��OH��3��ABD
����������1���ڸ����£����ۺ�ˮ������Ӧ����������������������������Ӧ�Ļ�ѧ����ʽΪ��Fe+4H2O��g�� ![]() Fe3O4+4H2�� �ʴ�Ϊ��Fe+4H2O��g��
Fe3O4+4H2�� �ʴ�Ϊ��Fe+4H2O��g�� ![]() Fe3O4+4H2����2��������������������������ͭ��Ӧ����ͭ���ʺ�ˮ����ˮ����ͭ��ˮ����ɫ������ʵ��װ������˳��Ϊafgbch������֤����Ϊ������ʵ�������Ǻ�ɫ������ͭ��ɺ�ɫ����ɫ����ˮ����ͭ�����ɫ���ʴ�Ϊ��fgbch����ɫ������ͭ��ɺ�ɫ����ɫ����ˮ����ͭ�����ɫ����3��������Һ���Ƿ���Fe3+�ļ����ǵ��뼸��KSCN��Һ���۲���Һ�Ƿ���ɫ������Һ���ɫ֤������Fe3+ �� �������ʴ�Ϊ��ȡ������Һ���Թ��У����뼸��KSCN��Һ������Һ��Ѫ��ɫ��֤�����������ӣ������������ӣ���4����Ӧ��������������������ϡ���ᷢ����ӦFe3O4+8H+=Fe2++2Fe3++4H2O�������۹����������Ժ������ӷ�Ӧ�����������ӣ�������Һ�п��ܺ��������ӣ�Ҳ���ܲ����������ӣ��ʴ�Ϊ�������Ӧ��Ļ�����к��й��������ۣ��ᷢ����Ӧ2Fe3++Fe=3Fe2+ �� ���۰�������ȫ����ԭΪ�������Ӻ����KSCN��Һ�����ɫ����5�����������������ȶ��Ӵ�����ʱ�ܿ챻����Ϊ������������Ӧ�Ļ�ѧ����ʽΪ��4Fe��OH��2+O2+2H2O=4Fe��OH��3���ʴ�Ϊ��4Fe��OH��2+O2+2H2O=4Fe��OH��3����Ҫ�ϳ�ʱ��۲쵽�����������İ�ɫ�������ؼ����������ͷ�Ӧ��ϵ�������������������ɵ������Ͼ�װ���е�����������Ӧ������ĵ缫������A�����������ĵ缫ӦΪ���������Ը���װ��ͼ��֪����Դ�е�aΪ������bΪ��������A��ȷ��B��������NaCl��Һ��Ϊ���Һ��������������������������������������������������������B��ȷ��C�������������缫��������һ��Ҫ�������缫����C����D�������������ӵõ��������������缫��Ӧʽ��2H++2e���TH2������D��ȷ����ѡ��ABD��
Fe3O4+4H2����2��������������������������ͭ��Ӧ����ͭ���ʺ�ˮ����ˮ����ͭ��ˮ����ɫ������ʵ��װ������˳��Ϊafgbch������֤����Ϊ������ʵ�������Ǻ�ɫ������ͭ��ɺ�ɫ����ɫ����ˮ����ͭ�����ɫ���ʴ�Ϊ��fgbch����ɫ������ͭ��ɺ�ɫ����ɫ����ˮ����ͭ�����ɫ����3��������Һ���Ƿ���Fe3+�ļ����ǵ��뼸��KSCN��Һ���۲���Һ�Ƿ���ɫ������Һ���ɫ֤������Fe3+ �� �������ʴ�Ϊ��ȡ������Һ���Թ��У����뼸��KSCN��Һ������Һ��Ѫ��ɫ��֤�����������ӣ������������ӣ���4����Ӧ��������������������ϡ���ᷢ����ӦFe3O4+8H+=Fe2++2Fe3++4H2O�������۹����������Ժ������ӷ�Ӧ�����������ӣ�������Һ�п��ܺ��������ӣ�Ҳ���ܲ����������ӣ��ʴ�Ϊ�������Ӧ��Ļ�����к��й��������ۣ��ᷢ����Ӧ2Fe3++Fe=3Fe2+ �� ���۰�������ȫ����ԭΪ�������Ӻ����KSCN��Һ�����ɫ����5�����������������ȶ��Ӵ�����ʱ�ܿ챻����Ϊ������������Ӧ�Ļ�ѧ����ʽΪ��4Fe��OH��2+O2+2H2O=4Fe��OH��3���ʴ�Ϊ��4Fe��OH��2+O2+2H2O=4Fe��OH��3����Ҫ�ϳ�ʱ��۲쵽�����������İ�ɫ�������ؼ����������ͷ�Ӧ��ϵ�������������������ɵ������Ͼ�װ���е�����������Ӧ������ĵ缫������A�����������ĵ缫ӦΪ���������Ը���װ��ͼ��֪����Դ�е�aΪ������bΪ��������A��ȷ��B��������NaCl��Һ��Ϊ���Һ��������������������������������������������������������B��ȷ��C�������������缫��������һ��Ҫ�������缫����C����D�������������ӵõ��������������缫��Ӧʽ��2H++2e���TH2������D��ȷ����ѡ��ABD��
��1���ڸ����£����ۺ�ˮ������Ӧ����������������������������2�����ɵ��������Ϊ����������������ͭ��Ӧ����ˮ������������ͭ��Ӧ֮ǰҪ����ݴ˼��鼴�ɣ���3��������Һ���Ƿ���Fe3+�ļ����ǵ��뼸��KSCN��Һ���۲���Һ�Ƿ���ɫ����4����Ӧ��������������������ϡ���ᷢ����ӦFe3O4+8H+=Fe2++2Fe3++4H2O�������۹����������Ժ������ӷ�Ӧ�����������ӣ�������Һ�п��ܺ��������ӣ�Ҳ���ܲ����������ӣ���5�����������������ȶ��Ӵ�����ʱ�ܿ챻����Ϊ����������
��Ҫ�ϳ�ʱ��۲쵽�����������İ�ɫ�������ؼ����������ͷ�Ӧ��ϵ�������������������ɵ������Ͼ�װ���е�����������Ӧ������ĵ缫�������ݴ˴��⣻



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵������ȷ����
A. ���κη����ж����л�ѧ��
B. �γ����Ӽ����������Ӽ�ֻ���ھ���������
C. CO2��PCl3����������ԭ�Ӷ����������8�����ȶ��ṹ
D. D2O��H2O�����������������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����й��ڻ�ѧ����˵������ȷ����
A. ��ѧ����һ��������
B. ��ѧ������ʹ�������ϣ�Ҳ����ʹԭ������
C. ��ѧ��Ӧ�����У���Ӧ������ڵĻ�ѧ�����ѣ������еĻ�ѧ���γ�
D. ���Լ����Ǽ��Լ�������ȶ����ڹ��ۼ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����ȷ����
A. ���ǽ���Ԫ�ظ��ǽ���Ԫ���γɵĻ����ﶼ�����ӻ�����
B. ����ǻ�ѧ����һ��
C. �ڢ�A��͵ڢ�A��ԭ�ӻ���ʱ��һ���������Ӽ�
D. ���ӻ������п��ܴ��ڹ��ۼ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ס��ҡ�����λͬѧ�ֱ�����ͼ��ʾʵ��װ����ȡ���ռ������� 
��1��������һλͬѧû���ռ�������������Ϊû���ռ���������ͬѧ������ס����ҡ���������ԭ���� ��
��2��Ҫ��ȡ�����İ�����Ӧ��ѡ������ס����ҡ�������ͬѧ��װ�ã�Ϊȷ���Թ����Ƿ����ռ����������ɽ�պŨ����IJ����������ռ�������Թܿڴ������۲쵽 �� ��˵���������ռ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ͼ��ʾװ�ý�������ʵ�飬�ܴﵽʵ��Ŀ���ǣ� ��
A.ƿ��ʢ��ˮ����B�ڽ���������ˮ���ռ�NO2
B.ƿ��ʢ����Ũ���ᣬ��A�ڽ���������NH3
C.��B�ڽ��������ſ������ռ�CO2
D.ƿ��װ��ˮ��A�������ܲ�������Ͳ�У���B�ڽ���������ˮ����������H2�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����NAΪ����٤��������ֵ������˵����ȷ���ǣ�������
A.S2��S8�Ļ���ﹲ6.4 g��������ԭ����һ��Ϊ0.2NA
B.��100 mL 0.1 molL��1��FeCl3��Һ�����ˮ�п��Ƶ�Fe��OH��3������ĿΪ0.01NA
C.�ڷ�ӦKClO3+6HCl�TKCl+3Cl2��+3H2O�У�ÿ����3 mol Cl2 �� ת�Ƶĵ�����Ϊ6NA
D.������1 mol Na2CO3����Һ��μ��뵽��1.5 mol HCl����Һ�У���������ķ�����ĿΪ0.5NA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������Ǽ����������ģ��(�����ʾ̼ԭ�ӣ���ԭ��ʡ��)��
��1��������������(����ĸ)��
��2����������ԭ�������ٵ���(����ĸ)��
��3������ģ���������������Ϊͬ���칹�塣
��4������ϩ������ �� ��д����ṹ��ʽ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������һ�ֳ��õ�ҽҩ�м��壬��ṹ��ͼ��ʾ�����й��ڰ������˵����ȷ���ǣ������� 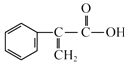
A.����ʽΪC9H10O2
B.�ܷ���ȡ�����Ӿۡ������ȷ�Ӧ
C.������Na2CO3��Һ��Ӧ�ų�����
D.1 mol����������ܺ�5 mol Br2�����ӳɷ�Ӧ
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com