
| A. | 该混盐的水溶液呈碱性 | |
| B. | 该混盐具有较强的氧化性 | |
| C. | 该混盐中氯元素的化合价为零 | |
| D. | 该混盐与硫酸反应产生71gCl2时转移1mol 电子 |
分析 由混盐CaOCl2在酸性条件下可以产生Cl2.可知混盐为CaCl2•Ca(ClO)2的形式,在酸性条件下发生:Cl-+ClO-+2H+=Cl2↑+H2O,Ca(ClO)2中Cl元素化合价为+1价,具有强氧化性,以此解答该题.
解答 解:A.混盐为CaCl2•Ca(ClO)2的形式,溶液呈碱性,故A正确;
B.混盐CaOCl2在酸性条件下可以产生Cl2,溶于水生成HClO,具有漂白性和强氧化性,故B正确;
C.混盐为CaCl2•Ca(ClO)2的形式,氯元素的化合价分别为+1、-1价,故C错误;
D.在酸性条件下发生:Cl-+ClO-+2H+=Cl2↑+H2O,由化合价可知产生1molCl2时转移1mole-,故D正确;
故选C.
点评 本题以含氯化合物为载体考查氧化还原反应,题目难度中等,注意把握混盐的成分为解答该题的关键,学习中注意把握相关物质的性质.


 课堂练加测系列答案
课堂练加测系列答案 轻松课堂单元测试AB卷系列答案
轻松课堂单元测试AB卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 能使广泛pH试纸显红色的溶液:K+、Ba2+、Cl-、Br- | |
| B. | 含有大量Al3+的溶液:Na+、Cl-、HCO3-、SO42- | |
| C. | 能使淀粉碘化钾试纸显蓝色的溶液:K+、SO42-、S2-、SO32- | |
| D. | 常温下$\frac{c({H}^{+})}{c(O{H}^{-})}$=1012的溶液:Fe2+、Mg2+、NO3-、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碳酸钠溶液呈碱性,可用于洗去铁屑表面的油污 | |
| B. | 铝易发生钝化,可用于作飞机、火箭的结构材料 | |
| C. | 炭具有还原性,可用于冶炼钠、镁、铝等金属 | |
| D. | 浓硫酸具有强氧化性,可用于干燥二氧化硫气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
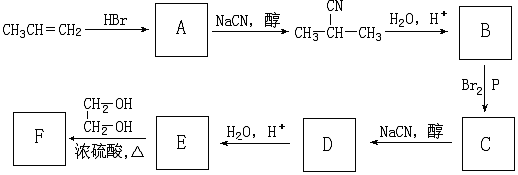
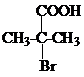 +NaCN$\stackrel{醇}{→}$NaBr+
+NaCN$\stackrel{醇}{→}$NaBr+ ,E→F(F为高分子时)nHOOC-C(CH3)2-COOH+nHOCH2CH2OH$→_{△}^{浓硫酸}$
,E→F(F为高分子时)nHOOC-C(CH3)2-COOH+nHOCH2CH2OH$→_{△}^{浓硫酸}$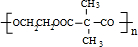 +2nH2O.
+2nH2O.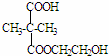 ,②分子内含有一个七元环
,②分子内含有一个七元环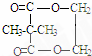 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 化学用语 | 推论 |
| A | ${\;}_{92}^{238}$U3+ | 该铀离子核外有89个电子 |
| B | 2H2(g)+O2(g)═2H2O(g);△H=-483.6kJ•mol | 1mol氢气完全燃烧放出热量483.6kJ. |
| C | 2NaCl+2H2O $\frac{\underline{\;电解\;}}{\;}$2NaOH+H2↑+Cl2↑ | NaCl氧化性比Cl2强 |
| D | FeO+4H++NO3-═Fe3++NO2↑+2H2O | 氧化亚铁溶于稀硝酸的离子方程式 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com