
| ѡ�� | ��ѧ���� | ���� |
| A | ${\;}_{92}^{238}$U3+ | �������Ӻ�����89������ |
| B | 2H2��g��+O2��g���T2H2O��g������H=-483.6kJ•mol | 1mol������ȫȼ�շų�����483.6kJ�� |
| C | 2NaCl+2H2O $\frac{\underline{\;���\;}}{\;}$2NaOH+H2��+Cl2�� | NaCl�����Ա�Cl2ǿ |
| D | FeO+4H++NO3-�TFe3++NO2��+2H2O | ������������ϡ��������ӷ���ʽ |
| A�� | A | B�� | B | C�� | C | D�� | D |
���� A��ԭ����������=������+�����������������=������=����������������ӵ���������ԭ�ӵ�����-ʧȥ�ĵ�������
B���Ȼ�ѧ����ʽ�е��ʱ���������ȫ��Ӧ�ų��������������Ȼ�ѧ����ʽ������ϵ���㣻
C����ⷴӦ���ڷ��Է����е�������ԭ��Ӧ���ڵ����������²ŷ����ķ�Ӧ���ܾݴ˷�Ӧ�ж������Ե�ǿ����
D��������������ϡ���ᷢ��������ԭ��Ӧ����һ��������
��� �⣺A.${\;}_{92}^{238}$U3+���Ӻ��������92-3=89����A��ȷ��
B.2H2��g��+O2��g���T2H2O��g������H=-483.6kJ•mol��1mol������ȫȼ�շų�����241.8kJ����B����
C��2NaCl+2H2O$\frac{\underline{\;ͨ��\;}}{\;}$2NaOH+H2+Cl2�����ڵ����������²ŷ����ķ�Ӧ���ܾݴ˷�Ӧ�ж������Ե�ǿ����Ӧ������Ԫ�صĻ��ϼ��жϣ�Cl2�����Ա�NaClǿ����C����
D��ϡ����Ļ�ԭ����һ��ΪNO������������������ϡ����������������NO����D����
��ѡA��
���� ���⿼���˺�����ӵļ��㡢�Ȼ�ѧ����ʽ�����塢�����ԵıȽ��Լ����ӷ���ʽ���жϣ���Ŀ�Ѷ��еȣ����ջ����ǽ���ؼ���



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 100��ʱ��ij��ҺpH=6�������Һһ�������� | |
| B�� | 25��ʱ��0.1mol/L��NaHSO3��ҺpH=4����Һ��c��SO32-����c��H2SO3�� | |
| C�� | 25��ʱ��pH=3��������Һ��pH=11�İ�ˮ�������ϣ�������Һ������ | |
| D�� | �����£�10mL0.1mol/L CH3COOH��Һ��5mLO��lmol/LNaOH��Һ��ϣ�������Һ���У�2c��H+��+c��CH3COOH��=c��CH3COO-��+2c��OH-�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �û��ε�ˮ��Һ�ʼ��� | |
| B�� | �û��ξ��н�ǿ�������� | |
| C�� | �û�������Ԫ�صĻ��ϼ�Ϊ�� | |
| D�� | �û��������ᷴӦ����71gCl2ʱת��1mol ���� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | һ���¶��£�ij�ܱ������������·�Ӧ��CaCO3��s��?CaO��s��+CO2��g�����ﵽƽ������������СΪԭ����һ�룬����ϵ�ٴδﵽ��ѧƽ��ʱ��CO2�����ʵ���Ũ�Ȳ��� | |
| B�� | ��֪ij�¶��£�Kw=l��10-13������pH=8��NaOH��Һ��pH=5��H2SO4��Һ��ϣ������¶Ȳ��䣬��ʹ�����ҺpH=7����NaOH��Һ��H2SO4��Һ�������Ϊ11��9 | |
| C�� | ��֪��KSP��AgCl��=1.8��10-10��Ksp��Ag2CrO2��=2.0��10-12����0.001 mol•L-1��AgNO3��Һ����0.001mol•L-1 KCl��0.001 rnol•L-1IK2CrO4�Ļ����Һ�У��Ȳ���AgCl���� | |
| D�� | ��֪25��ʱ���й�����ĵ���ƽ�ⳣ����HCNKa=4.9��10-10��H2CO3��Ka1=4.3��10-7��Ka2=5.6��10-11����CO2ͨ��NaCN��Һ�з�Ӧ�Ļ�ѧ����ʽΪ��2NaCN+H2O+CO2�T2HCN+Na2CO3 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
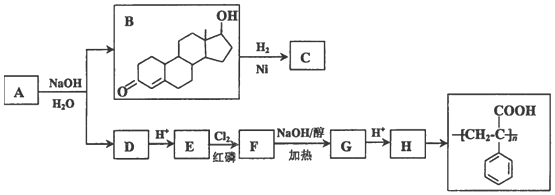
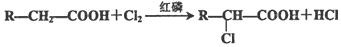
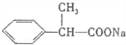 ��
��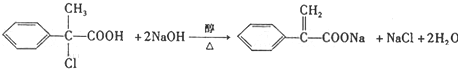 ��
�� ��
�� ��
���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
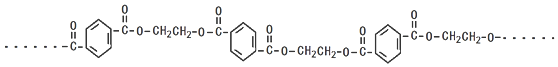
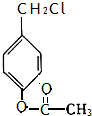
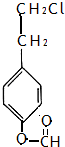
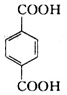 �����ӽ�С�ĵ��庬���������������ǻ���
�����ӽ�С�ĵ��庬���������������ǻ���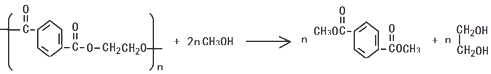 ��
��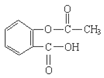 ����ԭ�ϣ�
����ԭ�ϣ�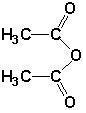 ����Ӧ���ɰ�˾ƥ�ֵĻ�ѧ����ʽ��
����Ӧ���ɰ�˾ƥ�ֵĻ�ѧ����ʽ��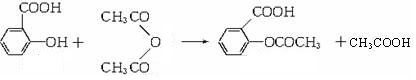 ��
�� ����ͬ���칹���������������
����ͬ���칹����������������鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | a=2 | |
| B�� | x=18 | |
| C�� | M�Ļ�ѧʽΪMgO | |
| D�� | �÷�Ӧ��Mg5Al3��OH��x��H2O��4�������������ǻ�ԭ�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
| t/�� | 700 | 800 | 900 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��ƶ���
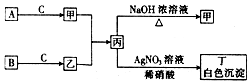 ��֪A��B��CΪ��ѧ���������嵥�ʣ��ס��ҡ�������Ϊ�����Ļ������ˮ��Һ�ʼ��ԣ�����֮������ͼ��ʾ��ת����ϵ�����ֲ��P��Ӧ��������ȥ��
��֪A��B��CΪ��ѧ���������嵥�ʣ��ס��ҡ�������Ϊ�����Ļ������ˮ��Һ�ʼ��ԣ�����֮������ͼ��ʾ��ת����ϵ�����ֲ��P��Ӧ��������ȥ���鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com