
| A�� | a=2 | |
| B�� | x=18 | |
| C�� | M�Ļ�ѧʽΪMgO | |
| D�� | �÷�Ӧ��Mg5Al3��OH��x��H2O��4�������������ǻ�ԭ�� |
���� ��2Mg5Al3��OH��x��H2O��4$\frac{\underline{\;��\;}}{\;}$27H2O��+10M+aAl2O3������Alԭ���غ㣬a=3��Hԭ���غ㣬x=19��Mg��Oԭ���غ��Ƴ�M�Ļ�ѧʽΪMgO���ݴ˷����жϣ�
��� �⣺��2Mg5Al3��OH��x��H2O��4$\frac{\underline{\;��\;}}{\;}$27H2O��+10M+aAl2O3������Alԭ���غ㣬a=3��Hԭ���غ㣬x=19��Mg��Oԭ���غ��Ƴ�M�Ļ�ѧʽΪMgO����Ӧǰ�����ϼ۱仯������ABD����C��ȷ��
��ѡ��C��
���� �����ѶȲ������÷�Ӧǰ��ԭ���غ����ж����ʵ�ϵ�������ʵĻ�ѧʽ�ǽ���Ĺؼ���


 С�����ϵ�д�
С�����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
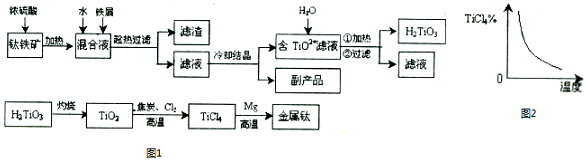
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| ѡ�� | ��ѧ���� | ���� |
| A | ${\;}_{92}^{238}$U3+ | �������Ӻ�����89������ |
| B | 2H2��g��+O2��g���T2H2O��g������H=-483.6kJ•mol | 1mol������ȫȼ�շų�����483.6kJ�� |
| C | 2NaCl+2H2O $\frac{\underline{\;���\;}}{\;}$2NaOH+H2��+Cl2�� | NaCl�����Ա�Cl2ǿ |
| D | FeO+4H++NO3-�TFe3++NO2��+2H2O | ������������ϡ��������ӷ���ʽ |
| A�� | A | B�� | B | C�� | C | D�� | D |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
| ���� | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN |
| pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��Ũ�������ķ�Ӧ����������ԭ��Ӧ | |
| B�� | ��������������ȼ�����ɴ���SO3 | |
| C�� | SO2��ʹ���Ը��������Һ��ɫ��������Ư���� | |
| D�� | ����������������ƾ�����ϸ���������������Ѿ��������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����
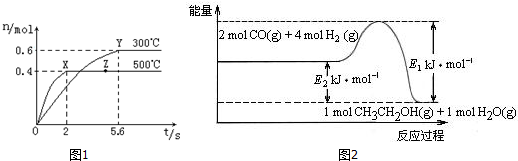
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 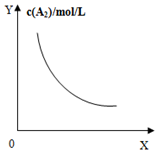 ���ڷ�Ӧ��A2��g��+3B2��g��?2AB2��g����ͼ���еĺ���x���Ա�ʾѹǿ | |
| B�� | 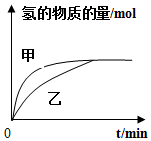 ��ͼ��ʾ����������ͬʱ���ס������ݵ�����п�۷ֱ�������ϡ���ᷴӦ�����м�������ͭ�� | |
| C�� | 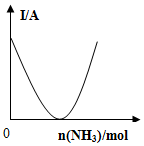 ��ͼ�ɱ�ʾ������Һ��ͨ�백��������ʱ��Һ�����Եı仯 | |
| D�� | 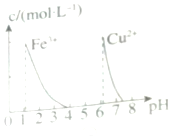 ��ͼ������ȥ0.1mol•L-1CuSO4��Һ�е�Fe3+��������Һ�м�������NaOH��pHԼΪ7 |
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com