
分析 元素W的一种核素的中子数为0,应为H,X的原子最外层电子数是次外层的2倍,应为C元素,Z与M同主族,Z2-电子层结构与氖相同,则Z为O元素,M为S元素,由此可知Y为N元素.
(1)M为S元素,位于周期表第三周期族VIA;
(2)向p溶液中加入FeCl3溶液,溶液变血红色,说明含有SCN-离子,向p溶液中加入NaOH溶液并加热可放出使湿润的红色石蕊试纸变蓝的气体,说明含有铵根离子;
(3)X中三种元素的原子数目之比为1:1:1,设分子式为:(CON)x,则x=$\frac{84}{12+16+14}$=2,所以分子式为:(CON)2,各原子均达到8电子稳定结构,可确定结构式;
(4)(CN)2的性质与Cl2相似,(CN)2与NaOH溶液反应生成CN-、CNO-、H2O;
(5)常温下,1molO3能与N的最简单氢化物反应,生成一种常见的盐和1molN2,盐为硝酸铵.
解答 解:元素W的一种核素的中子数为0,应为H,X的原子最外层电子数是次外层的2倍,应为C元素,Z与M同主族,Z2-电子层结构与氖相同,则Z为O元素,M为S元素,由此可知Y为N元素.
(1)M为S元素,位于周期表第三周期族VIA,故答案为:三;VIA;
(2)向p溶液中加入FeCl3溶液,溶液变血红色,说明含有SCN-离子,向p溶液中加入NaOH溶液并加热可放出使湿润的红色石蕊试纸变蓝的气体,说明含有铵根离子,则应为NH4SCN.故答案为:NH4SCN;
(3)X中三种元素的原子数目之比为1:1:1,设分子式为:(CON)x,则x=$\frac{84}{12+16+14}$=2,所以分子式为:(CON)2,各原子均达到8电子稳定结构,且分子中无双键,所以结构式为:N≡C-O-O-C≡N,
故答案为:N≡C-O-O-C≡N;
(4)(CN)2的性质与Cl2相似,(CN)2与NaOH溶液反应的离子方程式为(CN)2+2OH-=CN-+CNO-+H2O,故答案为:(CN)2+2OH-=CN-+CNO-+H2O;
(5)常温下,1mol O3能与N的最简单氢化物反应,生成一种常见的盐和1molO2,该反应的化学方程式为2NH3+2O3=NH4NO3+O2+H2O,
故答案为:2NH3+2O3=NH4NO3+O2+H2O.
点评 本题考查了元素周期表和元素周期律的综合应用,为高频考点,侧重于学生的分析能力的考查,题目涉及化学反应方程式、元素周期律等知识点,难度不大.


 黄冈小状元口算速算练习册系列答案
黄冈小状元口算速算练习册系列答案 成功训练计划系列答案
成功训练计划系列答案 倍速训练法直通中考考点系列答案
倍速训练法直通中考考点系列答案 一卷搞定系列答案
一卷搞定系列答案 名校作业本系列答案
名校作业本系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
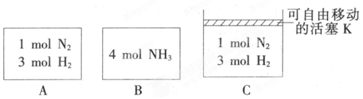
| A. | 一定温度下,某密闭容器发生如下反应:CaCO3(s)?CaO(s)+CO2(g),达到平衡后,将容器体积缩小为原来的一半,当体系再次达到化学平衡时,CO2的物质的量浓度不变 | |
| B. | 已知某温度下,Kw=l×10-13,若将pH=8的NaOH溶液与pH=5的H2SO4溶液混合,保持温度不变,欲使混合溶液pH=7,则NaOH溶液与H2SO4溶液的体积比为11:9 | |
| C. | 已知:KSP(AgCl)=1.8×10-10,Ksp(Ag2CrO2)=2.0×10-12,将0.001 mol•L-1的AgNO3溶液滴入0.001mol•L-1 KCl和0.001 rnol•L-1IK2CrO4的混合溶液中,先产生AgCl沉淀 | |
| D. | 已知25℃时,有关弱酸的电离平衡常数:HCNKa=4.9×10-10:H2CO3,Ka1=4.3×10-7,Ka2=5.6×10-11.则CO2通入NaCN溶液中反应的化学方程式为:2NaCN+H2O+CO2═2HCN+Na2CO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
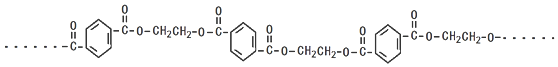
 ,分子较小的单体含氧官能团名称是羟基.
,分子较小的单体含氧官能团名称是羟基.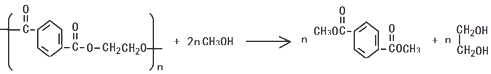 .
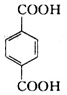
.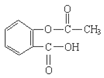 )的原料.
)的原料.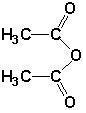 )反应生成阿司匹林的化学方程式:
)反应生成阿司匹林的化学方程式: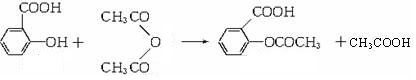 .
. ,该同分异构体符合以下条件:
,该同分异构体符合以下条件:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | a=2 | |
| B. | x=18 | |
| C. | M的化学式为MgO | |
| D. | 该反应中Mg5Al3(OH)x(H2O)4既是氧化剂又是还原剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SiO2通常用于通讯行业 | |
| B. | 发酵粉中主要含有碳酸氢钠,能使焙制出的糕点疏松多孔;而碳酸钠可作医疗上治疗胃酸过多的一种药剂 | |
| C. | 明矾可用作净水剂 | |
| D. | 金属钠可用于冶炼钛等金属 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| t/℃ | 700 | 800 | 900 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 【化学-选修2化学与技术】
【化学-选修2化学与技术】| 化学键 | C≡O | O═O | C═O(CO2中) |
| 键能(kJ•mol-1) | 958.5 | 497 | 745 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
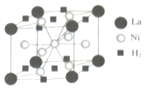 钒和镍及其化合物是重要的催化剂和合金材料.请回答:
钒和镍及其化合物是重要的催化剂和合金材料.请回答: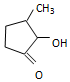 可形成配合物.
可形成配合物. 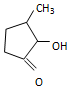 中,三种非金属原子的第一电离能由大到小的顺序为O>C>H(用元素符号表示);C原子的杂化轨道类型为sp3和sp2.
中,三种非金属原子的第一电离能由大到小的顺序为O>C>H(用元素符号表示);C原子的杂化轨道类型为sp3和sp2.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com