
 【化学-选修2化学与技术】
【化学-选修2化学与技术】| 化学键 | C≡O | O═O | C═O(CO2中) |
| 键能(kJ•mol-1) | 958.5 | 497 | 745 |
分析 (1)氧化还原反应中元素化合价升高的被氧化得到氧化产物;
(2)C2O3是一种无色无味的气体,可溶于水生成草酸(H2C2O4),与足量Ba(OH)2溶液混合发生酸碱中和反应生成盐和水;
(3)依据图表键能计算反应焓变,CO(g)+$\frac{1}{2}$O2(g)=CO2(g)△H2 ,结合热化学方程式和盖斯定律计算③-②-3×①得到所需热化学方程式;
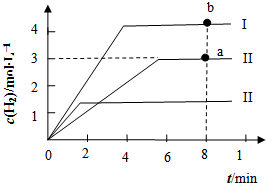
(4)①若曲线Ⅰ代表的是仅变化一种条件后的情况,曲线Ⅰ达到平衡所需时间少,说明反应速率快,且生成氢气浓度大,平衡正向进行,改变条件是升温;
②曲线Ⅱ对应反应的平衡常数=$\frac{生成物平衡浓度幂次方乘积}{反应物平衡浓度幂次方乘积}$,结合三行计算列式计算平衡浓度计算得到,若将等物质的量浓度的CH4、H2O、CO、H2混合在该容器中,计算此时浓度商和平衡常数比较判断反应进行的方向;
③曲线Ⅲ相对于曲线Ⅱ,达到平衡所需时间短,反应速率快,氢气浓度减小说明平衡逆向进行.
解答 解:(1)Mg17Al12+17H2=17MgH2+12Al,此变化中镁元素化合价0价变化为+2价,被氧化得到氧化产物是MgH2,故答案为:MgH2;
(2)C2O3是一种无色无味的气体,可溶于水生成草酸(H2C2O4),与足量Ba(OH)2溶液混合发生酸碱中和反应生成盐和水,反应的化学方程式为:C2O3+Ba(OH)2=BaC2O4↓+H2O,故答案为:C2O3+Ba(OH)2=BaC2O4↓+H2O;
(3)CO(g)+$\frac{1}{2}$O2(g)=CO2(g)△H2 =(958.5+$\frac{1}{2}$×497-2×745)KJ/mol=-283KJ/mol,
①H2(g)+$\frac{1}{2}$O2(g)=H2O(g)△H1=-198kJ•mol-1
②CO(g)+$\frac{1}{2}$O2(g)=CO2(g)△H2=-282.9KJ/mol,
③CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H3=-846.3kJ•mol-1
依据盖斯定律计算③-②-3×①得到CH4(g)+H2O(g)?CO(g)+3H2(g)△H=30.7KJ/mol,
故答案为:CH4(g)+H2O(g)?CO(g)+3H2(g)△H=30.7KJ/mol;
(4)①若曲线Ⅰ代表的是仅变化一种条件后的情况,曲线Ⅰ达到平衡所需时间少,说明反应速率快,且生成氢气浓度大,平衡正向进行,改变条件是升温,a、b两点后,a点温度小于b点,所以用CO浓度变化表示的反应速率关系为a<b,
故答案为:升温;a<b;
②结合三行计算列式计算平衡浓度计算得到,图象中可知达到平衡状态氢气浓度为3mol/L,
CH4(g)+H2O(g)?CO(g)+3H2(g)
起始量(mol/L) 1.5 2 0 0
变化量(mol/L) 1 1 1 3
平衡量(mol/L) 0.5 1 1 3
曲线Ⅱ对应反应的平衡常数=$\frac{生成物平衡浓度幂次方乘积}{反应物平衡浓度幂次方乘积}$=$\frac{3{\;}^{3}×1}{0.5×1}$=54,
若将等物质的量浓度的CH4、H2O、CO、H2混合在该容器中,设物质的量浓度为c,计算此时浓度商Qc=$\frac{c{\;}^{3}×c}{c×c}$=c2,和平衡常数无法比较大小,所以反应进行方向无法确定,开始时H2的生成速率和氢气消耗数量无法确定,
故答案为:54;无法确定;
③曲线Ⅲ相对于曲线Ⅱ,达到平衡所需时间短,反应速率快,氢气浓度减小说明平衡逆向进行,
A.降低温度反应速率减小,达到平衡时间增大,故A错误;
B.使用催化剂加快反应速率、降低温度平衡逆向进行,氢气浓度减小,故B正确;
C.充入氦气总压增大,气体分压不变平衡不变,故C错误;
故答案为:B.
点评 本题考查了氧化还原反应、热化学方程式和盖斯定律计算应用、焓变的计算、反应速率和化学平衡影响因素分析判断、注意图象曲线变化的特征和化学平衡移动原理的理解应用,掌握基础是解题关键,题目难度中等.


 七星图书口算速算天天练系列答案
七星图书口算速算天天练系列答案 初中学业考试导与练系列答案
初中学业考试导与练系列答案科目:高中化学 来源: 题型:解答题
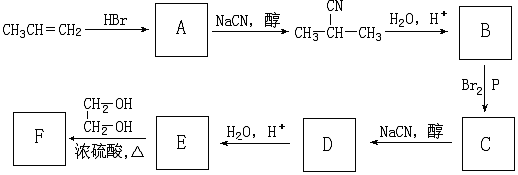
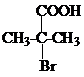 +NaCN$\stackrel{醇}{→}$NaBr+
+NaCN$\stackrel{醇}{→}$NaBr+ ,E→F(F为高分子时)nHOOC-C(CH3)2-COOH+nHOCH2CH2OH$→_{△}^{浓硫酸}$
,E→F(F为高分子时)nHOOC-C(CH3)2-COOH+nHOCH2CH2OH$→_{△}^{浓硫酸}$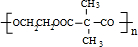 +2nH2O.
+2nH2O.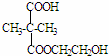 ,②分子内含有一个七元环
,②分子内含有一个七元环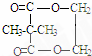 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 温度 | 25℃~550℃~600℃~700℃ |
| 主要成分 | WO3 W2O5 WO2 W |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 化学键 | N≡O | Cl-Cl | Cl-N | N=O |
| 键能/kJ.mol-1 | 630 | 243 | a | 607 |
| 序号 | c(ClNO)/mol.L-1 | v/mol.L-1•s-1 |
| ① | 0.30 | 3.60×10${\;}^{-{9}^{\;}}$ |
| ② | 0.60 | 1.44×10-8 |
| ③ | 0.90 | 3.24×10-8 |
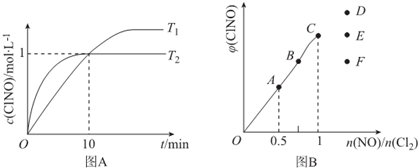
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 性质 | 实际应用 |
| A | MgO熔点高 | 可用作耐火材料 |
| B | KMnO4具有强氧化性 | 可用于漂白织物 |
| C | 常温下,铁能被浓硫酸钝化 | 常温下,可用铁质器皿盛放浓硫酸 |
| D | TiCl4在水中能发生水解 | 可用TiCl4溶液制备TiO2 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| 物质 | 杂质 | 试剂或用品 | 主要操作 | |
| A | 淀粉 | 碘化钾 | 半透膜 | 渗析 |
| B | Fe(NO3)2 | Ba(NO3)2 | 硫酸 | 过滤 |
| C | Fe | I2 | / | 加热 |
| D | 溴 | 四氧化碳 | 蒸馏装置 | 蒸馏 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com