
��8�֣��״���CH3OH)����Ϊ21���͵�����ȼ�ϣ���úΪԭ���Ʊ��״����������£�
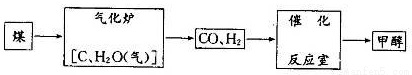
��1�� ����¯����Ҫ��Ӧ�Ļ�ѧ����ʽΪ ��
��2����֪CO��H2���״�(l)��ȼ���ȷֱ�Ϊ����285.8 kJ/mol����283 kJ/mol����726.5 kJ/mol��
��CO��H2 �ϳɼ״����Ȼ�ѧ����ʽΪ__ __
��3�� -�������£��ڴ���Ӧ���з�����Ӧ.CO(g)+2H2(g) =CH3OH(g)��H<0;
CO ��ƽ��ת�������¶ȡ�ѹǿ�Ĺ�ϵ��ͼ��ʾ���ش��������⣺
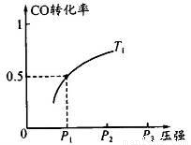
�ٹ�ҵ�ϣ�������Ӧ�¶Ȳ��˹��ߣ�ԭ����_ ___��
������Ӧ��1 mol CO��2 mol H2��2L�ݻ��н��У���
T1��P1�£��÷�Ӧ��ƽ�ⳣ��Ϊ__ __��
ά���¶ȡ��ݻ����䣬����Ӧ��������l mol CO��2 mol
H2���ﵽ��ƽ��ʱ��CO��ת����____�����������С�����䡱����
��1��C+ H2O (g)  CO+H2
CO+H2
��2��CO(g)+2H2(g)=CH3OH(l) ��H=-125.3kJ/mol
��3�� �ٸ÷�Ӧ�Ƿ��ȷ�Ӧ���¶ȹ��ߣ��״��IJ��ʵͣ�
��4 ����
��������
�����������1������¯�з����ķ�Ӧ������ˮú���ķ�Ӧ����ѧ����ʽΪC+ H2O (g)  CO+H2
CO+H2
��2��CO��H2 �ϳɼ״��Ļ�ѧ����ʽΪCO(g)+2H2(g)=CH3OH(l)���÷�Ӧ�ķ�Ӧ�ȡ�H��CO��H2���״�(l)��ȼ���ȵĹ�ϵ�ǡ�H=��285.8 kJ/mol+2������283 kJ/mol��-����726.5 kJ/mol��=-125.3kJ/mol������CO��H2 �ϳɼ״����Ȼ�ѧ����ʽΪCO(g)+2H2(g)=CH3OH(l) ��H=-125.3kJ/mol��
��3���ٸ÷�Ӧ���ȣ��¶ȹ��ߣ�����������Ӧ�Ľ��У��״��IJ��ʽ��ͣ�
��T1��P1�£�CO��ת������50%������ƽ��ʱ�״���Ũ��Ϊ1mol/2L��50%=0.25mol/L��CO��ƽ��Ũ��Ҳ��0.25mol/L,������ƽ��Ũ����CO��2��0.5mol/L�����Ը������µ�ƽ�ⳣ��K=0.25mol/L/0.25mol/L��0.52mol/L=4(L/mol)2��ά���¶ȡ��ݻ����䣬����Ӧ��������l mol CO��2 molH2��CO��H2�ı�����ԭƽ����ͬ����ЧΪ����ѹǿ��ƽ���������С�ķ����ƶ�����������Ӧ�ƶ���CO��ת��������
���㣺���黯ѧ��Ӧ�������Ĺ�ϵ����ѧƽ�����۵�Ӧ��


 ������ʱ����ҵ����ϵ�д�
������ʱ����ҵ����ϵ�д� ��ĩ���ƾ�ϵ�д�
��ĩ���ƾ�ϵ�д� ���ɿ��ñ���ϵ�д�
���ɿ��ñ���ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ��2015�찲��ʦ���и߶���ѧ�����п��黯ѧ�Ծ��������棩 ���ͣ�ѡ����
��20�棬5.05��105Pa�����£��ܱ������н��з�Ӧ2A(g)+xB(g) 4C(g)����ƽ��ʱc(A)=1.00mol?L-1���ֽ�ѹǿ��С��1.01��105Pa������ƽ���c(A)=0.18mol?L-1��������˵����ȷ���� ( )
4C(g)����ƽ��ʱc(A)=1.00mol?L-1���ֽ�ѹǿ��С��1.01��105Pa������ƽ���c(A)=0.18mol?L-1��������˵����ȷ���� ( )
A��ϵ��x >2
B�����������ϵ��ѹǿ��ƽ�������ƶ�����ѧƽ�ⳣ����С
C�����������ϵ��ѹǿ��ƽ�������ƶ�����ѧƽ�ⳣ������
D���÷�Ӧ�Ļ�ѧƽ�ⳣ������ʽ��K��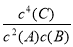
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015���Ĵ�ʡ������ѧ���Ի�ѧ�Ծ��������棩 ���ͣ�ѡ����
����ʵ������в��ᷢ����ȫ�¹ʵ���
A����п����ϡ���ᷴӦ��ȡ�������Ѳ���������ֱ�ӵ�ȼ���۲�ȼ������
B������ʯ����NH4Cl�����ϼ��Ȳ����������õ���ֱ��ͨ��ˮ����ȡŨ��ˮ
C��ȡ����������ʱ��Ӧ��ˮ���и���ף�ʣ��İ��������Ż�ԭ�Լ�ƿ��
D������ͭ��Ũ���ᷴӦʵ�����Թܣ������ô���ˮ��ϴ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015���Ĵ�ʡ�ɶ��и���������9���¿���ѧ�Ծ��������棩 ���ͣ�ѡ����
��NAΪ�����ӵ�������ֵ������˵����ȷ����
A��1L1mol��L��1��NaClO ��Һ�к���ClO������ĿΪNA
B��78g ������C��C˫������ĿΪ3NA
C�����³�ѹ�£�14g��N2��CO��ɵĻ�����庬�е�ԭ����ĿΪNA
D����״���£�6.72L NO2��ˮ��ַ�Ӧת�Ƶĵ�����ĿΪ0.1NA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015���Ĵ�ʡ�ɶ��и���������9���¿���ѧ�Ծ��������棩 ���ͣ�ѡ����
���л�ѧ������ȷ����
A����ϩ�ķ���ʽ��CH2===CH2
B����������ӵĽṹʽ��H��O��Cl
C���ǻ��ĵ���ʽ��
D���������������ʱ�������ĵ缫��Ӧʽ��Fe��3e��===Fe3��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015���Ĵ�ʡ�ɶ���2012������Ի�ѧ�Ծ��������棩 ���ͣ�ѡ����
25Cʱ����Ũ��Ϊ0.1000 mol/L��NaOH��Һ�ζ�20. 00 mL 0 .1000 mol��L-1��
CH3COOH.���ζ�������ͼ��ʾ�����з����������

A��C�����Һ��c��CH3COOһ��+c(CH.3COOH)>c(Na+)
B��B�����Һc (CH3COOһ)>c(Na+��>c(H+��> c(OH-)
C��A���������ֵΪl
D��D����Һ2c(CH3COOH)ʮc(H+) =c(OH��)��c(CH3COO��)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015���Ĵ�ʡ�ɶ���2012������Ի�ѧ�Ծ��������棩 ���ͣ�ѡ����
ij���������۾�����Ϊ����ͼ���ҵľۺ�������й�˵���������

A�����ɸþۺ���ķ�Ӧ���Ӿ۷�Ӧ
B���þۺ���ĵ����DZ�������
C��i�ۺ�������д��ڴ����ġ�OH�����Ծ��нϺõ���ˮ��
D���þۺ���ĽṹͲʽΪ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015�챱���и���8�¿�ѧ���Ի�ѧ�Ծ��������棩 ���ͣ�ѡ����
����Ȳ���������M�Ľṹ��ʽ��M��ϡ���������µ�ˮ�ⷴӦ��ͼ��ʾ�������й�˵������ȷ����

A��M��A����ʹ���Ը��������Һ����ˮ��ɫ
B��B�к����Ȼ����ǻ����ֹ����ţ��ܷ�����ȥ��Ӧ��������Ӧ
C��1 mol M���ȵ��ռ���Һ��Ӧ��������2n mol NaOH
D��A��B��C��1 mol�ֱ�������Ʒ�Ӧ���ų���������ʵ���֮��Ϊ1��2��2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015�����ɹų����Ԫ��ɽ���߶���ѧ����ĩ��ѧ�Ծ��������棩 ���ͣ�ѡ����
���������м��������ټ���(����400��)�������ʵ���Һ�����Եõ������ʹ�����ǣ� ��
A���Ȼ��� B��̼������ C���������� D������þ
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com