
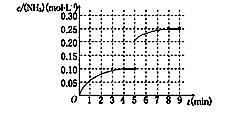
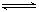 2NH3(g) ��H��0 ����Ӧ��NH3�����ʵ���Ũ�ȵı仯�������ͼ��ʾ����ش��������⣺
2NH3(g) ��H��0 ����Ӧ��NH3�����ʵ���Ũ�ȵı仯�������ͼ��ʾ����ش��������⣺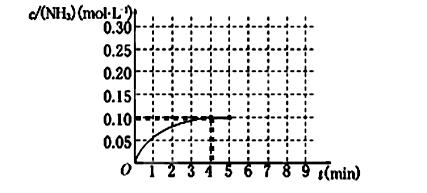
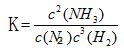 >
>
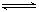 2NH3(g)
2NH3(g)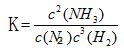 ����Ϊ����ӦΪ���ȷ�Ӧ���¶����ߣ�ƽ�����淴Ӧ�����ƶ���ƽ�ⳣ����С������K1>K2��
����Ϊ����ӦΪ���ȷ�Ӧ���¶����ߣ�ƽ�����淴Ӧ�����ƶ���ƽ�ⳣ����С������K1>K2��

 �ƸԹھ��ο���ϵ�д�
�ƸԹھ��ο���ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
 H2+I2
H2+I2
 H2��g��+I2��g����ƽ�ⳣ������ʽΪK=_______________________����ͬ�¶��£�����ʼ����HI��g�������ʵ�����ԭ����2������_________��ԭ����2����
H2��g��+I2��g����ƽ�ⳣ������ʽΪK=_______________________����ͬ�¶��£�����ʼ����HI��g�������ʵ�����ԭ����2������_________��ԭ����2���� 2SO3(g) + Q�����˷�Ӧ��ʼ�����ʵ�����ͬ�������й�ϵͼ��ȷ����_________ (�����)
2SO3(g) + Q�����˷�Ӧ��ʼ�����ʵ�����ͬ�������й�ϵͼ��ȷ����_________ (�����)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
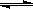 2XY��g�� ��H<0���ﵽ��ƽ�⡣�ڽ��ı�ijһ�����ﵽ��ƽ�⣬�Դ˹��̵ķ�����ȷ����( )
2XY��g�� ��H<0���ﵽ��ƽ�⡣�ڽ��ı�ijһ�����ﵽ��ƽ�⣬�Դ˹��̵ķ�����ȷ����( )
| A��ͼ��������ѹǿ�ı仯��� |
| B��ͼ����һ���Ǽ�������ı仯��� |
| C��ͼ��������ѹǿ�������¶ȵı仯��� |
| D��ͼ��һ���������¶ȵı仯��� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
 2NH3(g)��Q��Q��0��,
2NH3(g)��Q��Q��0��, | A��3V����H2����2V����NH3�� | B�������������ƽ������������ʱ����仯 |
| C��������������ܶȲ���ʱ����仯 | D������������ķ�����������ʱ����仯 |
| | A | B | C | D |
| �о�Ŀ�� | ѹǿ�Է�Ӧ��Ӱ�죨P1>P2�� | �¶ȶԷ�Ӧ��Ӱ�� | ƽ����ϵ����N2�Է�Ӧ��Ӱ�� | �����Է�Ӧ��Ӱ�� |
| ͼʾ |  |  |  |  |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 2Z(g)��H��0���÷�Ӧ�����ʣ�v����ʱ�䣨t���仯�Ĺ�ϵ����ͼ��ʾ��t2��t3��t5ʱ��������������ı䣬����û�иı�����ʵij�ʼ��������������˵���д������
2Z(g)��H��0���÷�Ӧ�����ʣ�v����ʱ�䣨t���仯�Ĺ�ϵ����ͼ��ʾ��t2��t3��t5ʱ��������������ı䣬����û�иı�����ʵij�ʼ��������������˵���д������
| A��t2ʱ�����˴��� |
| B��t3ʱ��С����ϵѹǿ |
| C��t5ʱ��������ϵ�¶� |
| D��t2��t3��t5�仯��Ӧ��ת���ʾ���t1ʱ��С |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
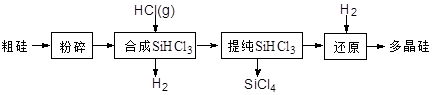
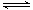 Si (s) + 3HCl (g) ��H ��0����ƽ�ⳣ������ʽΪK = ��Ϊ���ԭʱSiHCl3��ת���ʣ��ɲ�ȡ�Ĵ�ʩ�� ��
Si (s) + 3HCl (g) ��H ��0����ƽ�ⳣ������ʽΪK = ��Ϊ���ԭʱSiHCl3��ת���ʣ��ɲ�ȡ�Ĵ�ʩ�� ���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
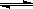 H2(g)+CO2(g)����Ӧ�����вⶨ�IJ������ݼ��±���
H2(g)+CO2(g)����Ӧ�����вⶨ�IJ������ݼ��±���| ��Ӧʱ��/min | 0 | 2 | 4 | 6 |
| n(CO)/mol | 1.20 | 0.90 | | 0.80 |
| n(H2O)/ mol | 0.60 | | 0.20 | |

| ��� | ҩƷ1 | ҩƷ2 | ʵ������ |
| I | 0.01 mol/L NaOH��Һ | 0.01 mol/L MgCl2��Һ | ���ɰ�ɫ���� |
| II | 0.01 mol/L��ˮ | 0.01 mol/L MgCl2��Һ | ������ |
| III | 0.1 mol/L��ˮ | 0.1 mol/L MgCl2��Һ | ����III |
| IV | 0.1 mol/L��ˮ | 0.01 mol/L MgCl2��Һ | ���ɰ�ɫ���� |
| V | 0.01 mol/L��ˮ | 0.1 mol/L MgCl2��Һ | ������ |
 2NH4+(aq) + Mg(OH)2(s)�÷�Ӧ��ѧƽ�ⳣ���ı���ʽΪK= ���г��÷�Ӧƽ�ⳣ��K��Kb(NH3��H2O)��Ksp(Mg(OH)2)�Ĺ�ϵʽ ��
2NH4+(aq) + Mg(OH)2(s)�÷�Ӧ��ѧƽ�ⳣ���ı���ʽΪK= ���г��÷�Ӧƽ�ⳣ��K��Kb(NH3��H2O)��Ksp(Mg(OH)2)�Ĺ�ϵʽ ���鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com