
【题目】氧化还原滴定同中和滴定类似(用已知浓度的氧化剂溶液滴定未知浓度的还原剂溶液或反之)。现用0.001 mol·L1酸性KMnO4溶液滴定未知浓度的无色NaHSO3溶液。反应的离子方程式为2![]() +5
+5![]() +H+
+H+![]() 2Mn2++5
2Mn2++5![]() +3H2O。
+3H2O。
请完成下列问题:
(1)该滴定实验所需仪器和用品是____________。
A 酸式滴定管(50 mL)B 碱式滴定管(50 mL) C 量筒(10 mL) D 锥形瓶 E 铁架台 F 滴定管夹 G 烧杯 H 白纸 I 胶头滴管 J 漏斗
(2)实验中用_____(填“酸”或“碱”)式滴定管盛装酸性KMnO4溶液,原因是_______。
(3)本实验_______(填“需要”或“不需要”)使用指示剂,滴定终点的现象是__________。
(4)①滴定前平视液面,刻度为a mL,滴定后俯视刻度为b mL,则(ba) mL比实际消耗KMnO4溶液的体积_____(填“大”或“小”),根据(ba) mL计算得到的待测液浓度比实际浓度_____(填“高”或“低”)。
②若滴定时所用的酸性KMnO4溶液因久置而导致浓度变小,则由此测得的待测液浓度值会____(填“偏小”“偏大”或“不变”)。
【答案】ADEFH 酸 酸性KMnO4溶液具有强氧化性,能腐蚀碱式滴定管的橡胶管 不需要 当看到加入最后1滴KMnO4溶液,锥形瓶中溶液由无色变为浅红色(或粉红色、红色),30s不褪色,即达到滴定终点 小 低 偏大
【解析】
类比中和滴定实验,回答有关氧化还原滴定的问题:仪器用品的选择、滴定终点的判断、实验误差分析等。
(1)用0.001 mol·L1酸性KMnO4溶液滴定未知浓度的NaHSO3溶液时,通常将酸性KMnO4溶液放在酸式滴定管中,NaHSO3溶液置于锥形瓶中,滴定管用铁架台、滴定管夹固定,锥形瓶下面垫一张白纸利于观察终点溶液颜色的变化。实验所需仪器和用品有ADEFH。
(2)酸性KMnO4溶液有酸性和强氧化性,会腐蚀碱式滴定管的橡胶管,故应放在酸式滴定管中,而不能放在碱式滴定管中。
(3)本实验中,酸性KMnO4溶液呈紫(红)色,NaHSO3溶液无色,而它们反应的产物几乎无色,故不需要使用指示剂。当加入最后1滴酸性KMnO4溶液,锥形瓶中溶液由无色变为浅红色(或粉红色、紫红色),且30s不褪色,即达到滴定终点。
(4)①滴定管0刻度在上,大刻度在下,则滴定后俯视读数b mL偏小,(ba) mL比实际消耗KMnO4溶液的体积小,据此应用化学方程式计算,得到的待测液浓度比实际浓度低。
②若酸性KMnO4溶液因久置而浓度变小,则氧化一定量![]() 所消耗酸性KMnO4溶液的体积偏大,由此计算得到的
所消耗酸性KMnO4溶液的体积偏大,由此计算得到的![]() 浓度偏大。
浓度偏大。


科目:高中化学 来源: 题型:
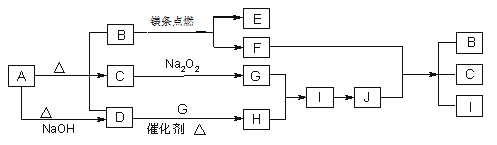
【题目】如图A~J分别代表相关反应中的一种物质,已知A分解得到等物质的量的B、C、D,常温下B、D为气态化合物,C为液态化合物,图中有部分生成物未标出。已知﹕2Mg+CO2![]() 2MgO+C。
2MgO+C。
请回答下列问题:
(1)写出A的化学式:___。
(2)写出下列反应的化学方程式:
D+G→H___。
F+J→B+C+I___。
(3)写出A+NaOH→D的离子方程式___。
查看答案和解析>>
科目:高中化学 来源: 题型:
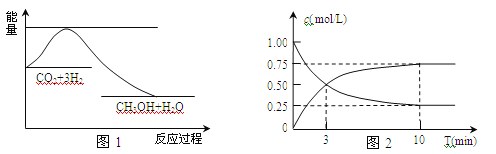
【题目】实现 “节能减排” 和“低碳经济”的一项重要课题就是如何将CO2转化为可利用的资源。目前工业上有一种方法是用CO2来生产燃料甲醇。一定条件下发生反应:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g),下图1表示该反应过程中能量(单位为kJ·mol-1)的变化。
CH3OH(g)+H2O(g),下图1表示该反应过程中能量(单位为kJ·mol-1)的变化。
(1)关于该反应的下列说法中,正确的是_________(填字母)。
A.ΔH<0,ΔS<0 B.ΔH>0,ΔS<0
C.ΔH>0,ΔS>0 D.ΔH<0,ΔS>0
(2)为探究反应原理,现进行如下实验,在体积为l L的密闭容器中,充入l mol CO2和4 mol H2,一定条件下发生反应:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g),测得CO2和CH3OH(g)的浓度随时间变化如上图2所示。
CH3OH(g)+H2O(g),测得CO2和CH3OH(g)的浓度随时间变化如上图2所示。
①从反应开始到平衡,H2的平均反应速率v(H2)=________;CO2的转化率w(CO2)=________。
②该反应的平衡常数K=_____________。(只列表达式和计算式,不必计算出结果)
③下列措施中能使化学平衡向正反应方向移动的是________________(填字母)。
A.将CH3OH(g)及时液化抽出 B.升高温度
C.选择高效催化剂 D.再充入l molCO2和4 molH2
(3)25℃,1.01×105Pa时,16 g 液态甲醇完全燃烧,当恢复到原状态时,放出350.8kJ的热量,写出该反应的热化学方程式:______________________。
(4)选用合适的合金为电极,以氢氧化钠、甲醇、水、氧气为原料,可以制成一种以甲醇为原料的燃料电池,其负极的电极反应式是:______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将E(g)和F(g)加入密闭容器中,在一定条件下发生反应:E(s)+4F(g)G(g),已知该反应的平衡常数如表所示。下列说法正确的是( )
温度/℃ | 25 | 80 | 230 |
平衡常数/(L3·mol-3) | 5×104 | 2 | 1.9×10-5 |
A.上述反应是熵增反应
B.25 ℃时,反应G(g)E(s)+4F(g)的平衡常数是0.5 mol3·L-3
C.在80 ℃时,测得某时刻,F、G的浓度均为0.5 mol·L-1,则此时v正>v逆
D.恒温恒容下,向容器中再充入少量G(g),达新平衡时,G的体积百分含量将增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.髙锰酸钾在实验室和工农业生产中有广泛的用途,实验室以二氧化锰为主要原料制备高锰酸钾,其部分流程如下:

(1)第①步加热熔融应在铁坩埚中进行,而不用瓷坩埚的原因是_______________________________(用化学方程式表示)。
(2)第④步通人适量CO2,发生反应生成MnO4-、MnO2和碳酸盐,则发生反应的离子方程式为_______________________________。
(3)第⑥步加热浓缩至液面有细小晶体析出时,停止加热,冷却结晶、过滤、洗涤、干燥,干燥过程中,温度不宜过高,其原因是_________________(用化学方程式表)。
(4)H2O2和KMnO4都是常用的强氧化剂,若向H2O2溶液中滴加酸性髙锰酸钾溶液,则酸性髙锰酸钾溶液会褪色,写出该反应的离子方程式: ________________________________。
II.某小组设计如图所示的装置图(图中夹持和加热装置略去),分别研究SO2和C12的性质。

(5)若从左端分别通入SO2和C12,装置A中观察到的现象是否相同______(填“相同”或“不相同”)。
(6)若装置B中装有5.0 mL 1.0 mol L-1的碘水,当通入足量Cl2完全反应后,共转移了5. 0×10-2 mol电子,则该反应的化学方程式为____________________________。
(7)若由元素S和O组成-2价酸根离子X,X中S和O的质量比为4 : 3;当Cl2与含有X的溶液完全反应后,有浅黄色沉淀产生,取上层清液加人氯化钡溶液,有白色沉淀产生。 写出Cl2与含有X的溶液反应的离子方程式: __________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列解释工业生产或应用的化学用语中,不正确的是
A. FeCl3溶液刻蚀铜电路板:2Fe3++Cu==2Fe2++Cu2+
B. Na2O2用作供氧剂:Na2O2+H2O==2NaOH +O2↑
C. 氯气制漂白液:Cl2+2NaOH==NaCl+NaClO +H2O
D. Na2CO3溶液处理水垢:CaSO4(s)+CO32![]() CaCO3(s)+SO42
CaCO3(s)+SO42
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学为了验证碳和硅两种元素非金属性的相对强弱,用如图所示装置进行实验(夹持仪器已略去,气密性已检验)。
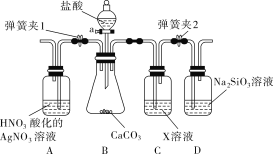
实验操作步骤:
①打开弹簧夹1,关闭弹簧夹2,并打开活塞a,滴加盐酸。
②A中看到白色沉淀时,…,关闭活塞a。
请回答:
(1)B中反应的离子方程式是___________。
(2)通过步骤①、②得知盐酸具有的性质是________(填字母)。
A.挥发性 B.还原性 C.氧化性 D.酸性
(3)C装置的作用是__________,X是________(写化学式)。
(4)为了验证碳的非金属性强于硅,步骤②中未写的操作和现象是___________。
(5)D中反应的化学方程式是________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了使宇航员在飞船中得到一个稳定的、良好的生存环境,一般在飞船内安装盛有Na2O2或K2O2颗粒的装置,它的用途是产生氧气,下列关于Na2O2的叙述正确的是( )
①Na2O2中阴、阳离子的个数比是1:1
②Na2O2分别与水及CO2反应产生等量氧气时,转移电子的物质的量相等
③Na2O2投入到紫色石蕊试液中,溶液先变蓝,后褪色
④Na2O2能与酸反应生成盐和水,所以Na2O2是碱性氧化物
⑤Na2O2与水反应,Na2O2既是氧化剂,又是还原剂
A.①③⑤B.②③⑤C.①②⑤D.①④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某种激光染料,它由C、H、O三种元素组成,分子球棍模型如图所下列有关叙述正确的是

①分子式为C10H8O3 ②不溶于水 ③1mol该物质最多能与4molH2加成
④能使酸性KMnO4溶液褪色 ⑤1mol该物质最多能与含2 mol NaOH的溶液反应
A. ①②③④ B. ③④⑤ C. ②③④ D. ②③④⑤
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com