
【题目】催化技术可处理汽车尾气:2NO+2CO2CO2+N2 , 某温度下在容积不变的密闭容器中通入NO 和CO,不同时间NO 和CO 的浓度如下表.下列说法中不正确的是( )
时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
c(NO)/×10﹣3molL﹣1 | 1.00 | 0.45 | 0.25 | 0.15 | 0.10 | 0.10 |
c(CO)/×10﹣3molL﹣1 | 3.60 | 3.05 | 2.85 | 2.75 | 2.70 | 2.70 |
A.2 s 内的平均反应速率υ(N2)=1.875×10﹣4 molL﹣1s﹣1
B.在该温度下K=5
C.若将容积缩小为原来的一半,NO 转化率大于90%
D.某时刻再充入0.1 mol NO,0.36 mol CO,重新达平衡后CO 浓度比原平衡大
【答案】B
【解析】解:A.2s内△c(NO)=(1﹣0.25)×10﹣3 molL﹣1=7.5×10﹣4 molL﹣1 , 则△c(N2)= ![]() △c(NO)=3.75×10﹣4 molL﹣1 , 则v(N2)=
△c(NO)=3.75×10﹣4 molL﹣1 , 则v(N2)= ![]() =1.875×10﹣4molL﹣1s﹣1 , 故A正确; B.4s时处于平衡状态,平衡时NO为1.0×10﹣3 molL﹣1 , 则:
=1.875×10﹣4molL﹣1s﹣1 , 故A正确; B.4s时处于平衡状态,平衡时NO为1.0×10﹣3 molL﹣1 , 则:
2NO(g)+2CO(g)2CO2(g)+N2(g)
起始量(×10﹣3 molL﹣1):1 3.6 0 0
变化量(×10﹣3 molL﹣1):0.9 0.9 0.9 0.45
平衡量(×10﹣3 molL﹣1):0.1 2.7 0.9 0.45
则平衡常数K= ![]() =
= ![]() =5000,故B错误;
=5000,故B错误;
C.原平衡时NO转化率为 ![]() =90%,若将容积缩小为原来的一半,增大压强,平衡正向移动,NO转化率增大,故新平衡时NO转化率大于90%,故C正确;
=90%,若将容积缩小为原来的一半,增大压强,平衡正向移动,NO转化率增大,故新平衡时NO转化率大于90%,故C正确;
D、某时刻再充入0.1 mol NO,0.36 mol CO,因为体积不变,加入一氧化碳的量增加,所以达到新平衡,CO的浓度也会增加,比原平衡的大,故D正确.
故选B.
【考点精析】掌握化学平衡状态本质及特征是解答本题的根本,需要知道化学平衡状态的特征:“等”即 V正=V逆>0;“动”即是动态平衡,平衡时反应仍在进行;“定”即反应混合物中各组分百分含量不变;“变”即条件改变,平衡被打破,并在新的条件下建立新的化学平衡;与途径无关,外界条件不变,可逆反应无论是从正反应开始,还是从逆反应开始,都可建立同一平衡状态(等效).


科目:高中化学 来源: 题型:
【题目】固定容积为2L的密闭容器中发生反应xA(g)+yB(g)zC(g),图I表示t℃时容器中各物质的量随时间的变化关系,图II表示平衡常数K随温度变化的关系.结合图象判断,下列结论正确的是( ) 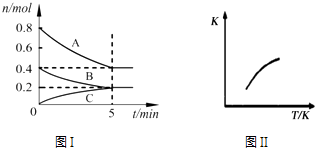
A.该反应可表示为:2A(g)+B(g)C(g)△H<0
B.t℃时该反应的平衡常数K=6.25
C.当容器中气体密度不再变化时,该反应达到平衡状态
D.t℃,在第6 min时再向体系中充入0.4 mol C,再次达到平衡时C的体积分数大于0.25
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下在密闭容器中发生如下反应:2M(g)+N(g)2E(g)若开始时只充入2molE(g),达平衡时,混合气体的压强比起始时增大了20%;若开始时只充入2molM和1molN的混合气体,达平衡时M的转化率为( )
A.20%
B.40%
C.60%
D.80%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学为了检验浓硫酸与木炭粉在加热条件下反应产生的所有气体产物,选用了下图所示实验装置.
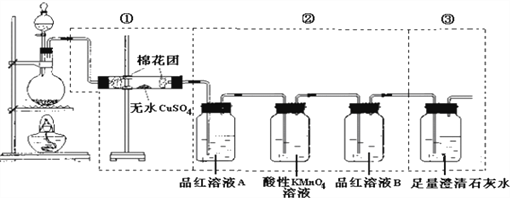
(1)写出浓硫酸和木炭粉在加热条件下发生反应的化学方程式 ___________________________.
(2)①中无水硫酸铜的作用是__________________________.
(3)②中酸性KMnO4溶液的作用是______________________________.
(4)②中两次用到品红溶液,它们的作用分别是A______________,B________________________.
(5)①装置和②装置不能互换的原因_______________________________
(6)证明产物中有CO2的离子反应方程式_________________________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质①乙烷 ②乙炔 ③甲苯 ④苯 ⑤聚乙烯 ⑥对苯二酚 ⑦溴乙烷 ⑧葡萄糖,其中既能与溴水反应又能与酸性高锰酸钾溶液反应的是( )
A.②③④⑤⑧
B.②③④⑥⑦⑧
C.②⑥⑧
D.②⑤⑥⑧
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
①非金属元素不可能组成离子化合物
②构成分子晶体的微粒一定含有共价键
③共价化合物中可能含有离子键
④离子化合物中可能含有共价键
⑤非极性键只存在于双原子单质分子里
⑥不同元素组成的多原子分子里的化学键一定都是极性键
A. ①②④⑥ B. ②④⑤⑥
C. ①③⑤⑥ D. 只有④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素在周期表中的位置,反映了元素的原子结构和元素的性质,下图是元素周期表的一部分:

(1)根据元素周期律,请你预测,H3AsO4、H3PO4的酸性强弱:H3AsO4________H3PO4(填“>”、“<”或“=”).
(2)根据NaH的存在,有人提议可把氢元素放在第ⅦA族,那么根据其最高正价与最低负价的绝对值相等,又可把氢元素放在周期表中的第________族.
(3)元素甲是第三周期金属元素中原子半径最小的元素,该元素的离子与过量氨水反应的离子方程式为:__________________________________________________________.
(4)周期表中有10多种人体所需的微量元素,其中有一种被誉为“生命元素”的主族元素R,对延长人类寿命起着重要作用.已知R元素的原子有4个电子层,其最高价氧化物的分子式为RO3,则R元素的名称为 : _____________________________________.
(5)羰基硫(COS)分子结构与二氧化碳分子结构相似,所有原子的最外层都满足8电子结构.用电子式表示羰基硫分子的形成过程:_____________________________________.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com